题目内容
已知可逆反应X(g)+Y(g)?Z(g)(未配平).温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )

| A.发生反应时,各物质的反应速率大小关系为:v(X)=v(Y)=2v(Z) |
| B.图a中反应达到平衡时,Y的转化率为37.5% |
| C.T0℃时,该反应的平衡常数为33.3 |
| D.该反应正反应的反应热△H<0 |

A、温度为T0时,X的物质的量浓度的变化量=(0.3-0.05)mol/L=0.25mol/L;
Y的物质的量浓度的变化量=(0.4-0.15)mol/L=0.25mol/L,
Z的物质的量浓度的变化(0.5-0)mol/L=0.5mol/L,该反应方程式为X(g)+Y(g)?2Z(g),
所以发生反应时,各物质的反应速率大小关系为,2v(X)=2v(Y)=v(Z),故A错误.
B、Y的转化率=
×100%=62.5%,故B错误.
C、平衡常数K=
=33.3,故C正确.
D、“先拐先平,数值大”,所以T1>T2,升高温度,Z的物质的量浓度增大,平衡向正反应方向移动,升高温度平衡向吸热反应方向移动,所以该反应的正反应方向是吸热反应,故D错误.
故选C.
Y的物质的量浓度的变化量=(0.4-0.15)mol/L=0.25mol/L,
Z的物质的量浓度的变化(0.5-0)mol/L=0.5mol/L,该反应方程式为X(g)+Y(g)?2Z(g),
所以发生反应时,各物质的反应速率大小关系为,2v(X)=2v(Y)=v(Z),故A错误.
B、Y的转化率=
| (0.4-0.15)mol/L |
| 0.4mol/L |
C、平衡常数K=
| (0.5mol/L)2 |
| 0.05mol/L×0.15mol/L |
D、“先拐先平,数值大”,所以T1>T2,升高温度,Z的物质的量浓度增大,平衡向正反应方向移动,升高温度平衡向吸热反应方向移动,所以该反应的正反应方向是吸热反应,故D错误.
故选C.

练习册系列答案
相关题目
已知可逆反应X(g)+Y(g)?Z(g)(未配平).温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )
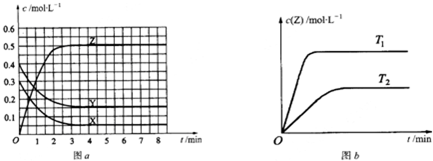

| A、发生反应时,各物质的反应速率大小关系为:v(X)=v(Y)=2v(Z) | B、图a中反应达到平衡时,Y的转化率为37.5% | C、增大压强,平衡向正反应方向移动 | D、该反应正反应的反应热△H>0 |
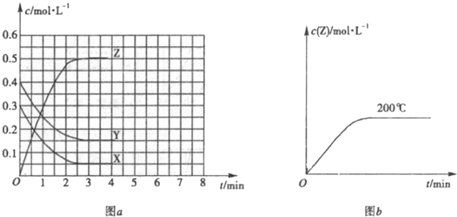
 已知可逆反应X(g)+Y(g)?Z(g)(未配平).温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )
已知可逆反应X(g)+Y(g)?Z(g)(未配平).温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )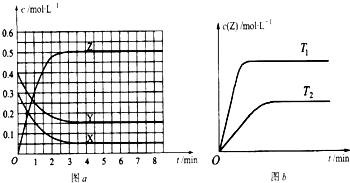 (2009?广州二模)已知可逆反应X(g)+Y(g)?Z(g)(未配平).温度为T0时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )
(2009?广州二模)已知可逆反应X(g)+Y(g)?Z(g)(未配平).温度为T0时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )