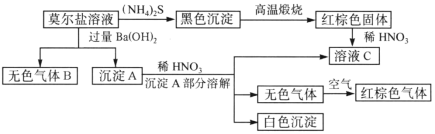
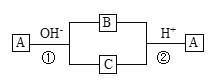
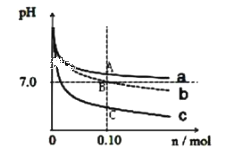
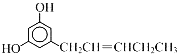题目内容
【题目】金属及其化合物在生产生活等各个领域有着广泛的应用。
(1)钛具有良好的金属性能。钛基态原子中电子占据能级个数为______。与钛同周期的元素中,基态原子的未成对电子数与钛相同的还有______种。钛比钢轻、比铝硬,是一种新兴的结构材料,钛硬度比铝大的可能原因是________。
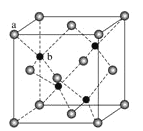
(2)有一种氮化钛晶体的晶胞与NaCl晶胞相似,该晶胞中N、Ti之间的最近距离为a×10-10cm,则该氮化钛的密度为_________g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。
(3)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。Li2O是尚子晶体,其晶格能可通过图(a)的Bom-Haber循环计算得到。

Li原子的第一电离能为______kJ·mol-1,O==O键键能为______kJ·mol-1,Li2O晶格能为_______kJ·mol-1。
(4)Zn可形成多种化合物,其中立方ZnS晶胞结构如下图,其阴离子(S2-)按面心立方密堆积排布,立方ZnS的配位数与NaCl不同,这是由__________因素决定的。
【答案】7 3 钛原子的价电子数比A1多,金属键更强 ![]() 520 498 2908 离子半径和离子电荷数
520 498 2908 离子半径和离子电荷数
【解析】
(1) 钛原子核外有22个电子,根据核外电子排布规律写出钛原子的电子排布式,再确定电子占据能级个数;基态Ti原子的未成对电子数为2,据此分析;
(2) 根据均摊法,可知该晶胞中N和Ti原子个数,再根据![]() =
=![]() 计算;
计算;
(3) Li原子的第一电离能是指1mol气态锂原子失去1mol电子变成1mol气态锂离子所吸收的能量;O![]() O键键能是指1mol氧气分子断裂生成气态氧原子所吸收的能量;晶格能是指气态离子结合生成1mol离子晶体所释放的能量或1mol离子晶体断裂离子键形成气态离子所吸收的能量,以此解答。
O键键能是指1mol氧气分子断裂生成气态氧原子所吸收的能量;晶格能是指气态离子结合生成1mol离子晶体所释放的能量或1mol离子晶体断裂离子键形成气态离子所吸收的能量,以此解答。
(4)配位数不同,跟几何或半径或电荷有关。
(1) 钛原子核外有22个电子,基态钛原子电子排布式为1s22s22p63s23p63d24s2,则电子占据能级个数为7;基态原子的未成对电子数为2;第四周期中未成对电子数为2的元素有Ge、Se、Ni,有3种;钛原子的价电子数是4、铝原子的价电子数是3,钛原子的价电子数比铝多,金属键更强,所以钛的硬度比铝大;
故答案为:7;3;钛原子的价电子数比Al多,金属键更强;
(2) 根据均摊法,可知该晶胞中N原子个数为6![]() +8
+8![]() =4,Ti原子个数为1+12
=4,Ti原子个数为1+12![]() =4,所以晶胞的质量为m=
=4,所以晶胞的质量为m=![]() g,而晶胞的体积V=(2a×10-10)3cm3,所以晶胞的密度
g,而晶胞的体积V=(2a×10-10)3cm3,所以晶胞的密度![]() =
= ![]() g·cm-3;
g·cm-3;
(3) Li原子的第一电离能是指1mol气态锂原子失去1mol电子变成1mol气态锂离子所吸收的能量,即为![]() =520kJ·mol-1;O=O键键能是指1mol氧气分子断裂生成气态氧原子所吸收的能量,即为249kJ·mol-1
=520kJ·mol-1;O=O键键能是指1mol氧气分子断裂生成气态氧原子所吸收的能量,即为249kJ·mol-1![]() =498 kJ·mol-1。晶格能是指气态离子结合生成1mol离子晶体所释放的能量或1mol离子晶体断裂离子键形成气态离子所吸收的能量,则Li2O晶格能为2908kJ·mol-1。
=498 kJ·mol-1。晶格能是指气态离子结合生成1mol离子晶体所释放的能量或1mol离子晶体断裂离子键形成气态离子所吸收的能量,则Li2O晶格能为2908kJ·mol-1。
因此,本题正确答案是:520 ;498 ;2908。
(4)根据均摊法可知,阴离子(S2- )的配位数为8×![]() +6×
+6×![]() =4,阳离子(Zn2+)的配位数为4,则S2-的配位数也是4,立方ZnS的配位数与NaCl不同,这是由高子半径和离子所带的电荷数等因素共同决定的。
=4,阳离子(Zn2+)的配位数为4,则S2-的配位数也是4,立方ZnS的配位数与NaCl不同,这是由高子半径和离子所带的电荷数等因素共同决定的。

【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是:___(填具体元素符号或化学式,下同)。⑥元素的原子结构示意图是___。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是__,碱性最强的化合物的化学式是___。
(3)最高价氧化物是两性氧化物的元素是_;写出它最高价氧化物对应水化物与氢氧化钠反应的化学方程式__。
(4)元素③与④形成淡黄色化合物的电子式:___,该化合物属于___(填“共价”或“离子”)化合物。
(5)用电子式表示③与①最高价态形成的化合物的形成过程___,将标准状况下4.48L该化合物通入足量的③和④形成的淡黄色固体化合物中,充分反应后,固体的质量增加___g。