题目内容
6.下列物质之间的转化,能一步完成的是( )| A. | CH3CH2OH→CH3CHO | B. | Fe2O3→Fe(OH)3 | C. | SiO2→H2SiO3 | D. | Al2O3→Al(OH)3 |
分析 A、乙醇催化氧化生成乙醛;
B、Fe2O3不溶于水;
C、二氧化硅不溶于水;
D、氧化铝和水不反应.
解答 解:A、乙醇在铜或银做催化剂的条件下能被氧气催化氧化生成乙醛,可以一步完成,故A正确;
B、Fe2O3不溶于水,不能和水一步反应生成氢氧化铁,故B错误;
C、二氧化硅不溶于水,不能够与水发生化合反应生成硅酸,故C错误;
D、氧化铝和水不反应,不能和水反应生成氢氧化铝,不能一步完成,故D错误.
故选A.
点评 本题考查了元素化合物的性质,熟悉相关的化学反应的方程式是解答的关键,题目较简单.

练习册系列答案
 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
16.把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池.A、B相连时,A为负极;C、D相连时,D上有气泡逸出;A、C相连时,A极减轻;B、D相连时,B为正极.则四种金属的活动性顺序由大到小排列为( )
| A. | A>B>C>D | B. | A>C>B>D | C. | A>C>D>B | D. | B>D>C>A |
17.下列有说法不正确的是( )
| A. | 离子晶体的晶格能是气态离子形成1mol晶胞时放出的能量 | |
| B. | 金属的六方最密堆积和面心立方最密堆积的空间利用率最高 | |
| C. | 钠晶胞结构如图 ,钠晶胞中每个钠原子的配位数为8 ,钠晶胞中每个钠原子的配位数为8 | |
| D. | 温度升高,金属的导电性将变弱 |
14.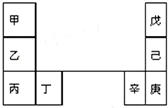 甲--辛等元素在周期表中的相对位置如图.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素,下列判断正确的是( )
甲--辛等元素在周期表中的相对位置如图.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素,下列判断正确的是( )
 甲--辛等元素在周期表中的相对位置如图.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素,下列判断正确的是( )
甲--辛等元素在周期表中的相对位置如图.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素,下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>己>戊 | |
| C. | 丙与庚的原子核外电子数相差14 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
11.已知Cu2+(aq)+MnS(s)?CuS(s)+Mn2+(aq),化工生产中常用MnS(s)作沉淀剂去除废水中的Cu2+.下列有关说法正确的是( )
| A. | 当c(Cu2+)=c(Mn2+)时该反应达到平衡 | |
| B. | 从该反应原理可以得出CuS的溶解度比MnS的溶解度大 | |
| C. | 该反应的平衡常数K=$\frac{{K}_{sp}(MnS)}{{K}_{sp}(CuS)}$ | |
| D. | 往平衡体系中加入少量CuSO4(s)后,c( Mn2+)不变 |
6.将水蒸气通过红热的碳可产生水煤气,以此产物为原料可生产多种产品.
(1)已知:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是AD.
A.升高温度B.增加碳的用量C.加入催化剂D.用储氢金属吸收H2

(2)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2(g)?MH2(s)△H<0(M表示某种合金).如图1表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系,则T1<T2(填“<”、“>”或“=”).
(3)某温度下,在2L体积不变的密闭容器中将1molCO和2molH2混合发生反应:CO(g)+2H2(g)?CH3OH(g),测得不同时刻的反应前后压强关系如表:
反应在前10min的平均速率v(H2)=0.015mol•L-1•min-1.达到平衡时CO的转化率为51%.
(4)CO可以还原某些金属氧化物生成金属单质和CO2,如图2是四种金属氧化物被CO还原时1g[$\frac{c(CO)}{c(C{O}_{2})}$)]与温度(T)的关系曲线图.
①其中最易被还原的金属氧化物是Cu2O(填化学式).
②700℃时CO还原Cr2O3反应中的平衡常数k=10-12.
(5)水煤气处理后,获得的较纯H2用于合成氨:N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1.如图3为不同实验条件下进行合成氨反应实验,N2浓度随时间变化示意图.
①与实验Ⅰ比较,实验Ⅱ改变的条件为使用催化剂.
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在图4中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图 .
.
(6)饮用水中的NO3-主要来自于NH4+,已知在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如图5.请写出1molNH4+(aq)的热化学方程式NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol.

(1)已知:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是AD.
A.升高温度B.增加碳的用量C.加入催化剂D.用储氢金属吸收H2

(2)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2(g)?MH2(s)△H<0(M表示某种合金).如图1表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系,则T1<T2(填“<”、“>”或“=”).
(3)某温度下,在2L体积不变的密闭容器中将1molCO和2molH2混合发生反应:CO(g)+2H2(g)?CH3OH(g),测得不同时刻的反应前后压强关系如表:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比($\frac{{P}_{后}}{{P}_{前}}$) | 0.98 | 0.90 | 0.78 | 0.66 | 0.66 | 0.66 |
(4)CO可以还原某些金属氧化物生成金属单质和CO2,如图2是四种金属氧化物被CO还原时1g[$\frac{c(CO)}{c(C{O}_{2})}$)]与温度(T)的关系曲线图.
①其中最易被还原的金属氧化物是Cu2O(填化学式).
②700℃时CO还原Cr2O3反应中的平衡常数k=10-12.
(5)水煤气处理后,获得的较纯H2用于合成氨:N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1.如图3为不同实验条件下进行合成氨反应实验,N2浓度随时间变化示意图.
①与实验Ⅰ比较,实验Ⅱ改变的条件为使用催化剂.
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在图4中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图
 .
.(6)饮用水中的NO3-主要来自于NH4+,已知在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如图5.请写出1molNH4+(aq)的热化学方程式NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol.

3.下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是( )
| 选项 | 离子组 | 加入试剂(溶液) | 加入试剂后发生反应的离子方程式 |
| A | SO42-、Fe2+、NO3-、K+ | K3[Fe(CN)6] | 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ |
| B | Na+、Fe3+、I-、ClO- | HCl | ClO-+H+=HClO |
| C | Ba2+、Al3+、Cl-、H+ | 少量NaOH | Al3++3OH-=Al(OH)3↓ |
| D | S2O32-、Na+、Cl-、SO32-、K+ | 过量硫酸 | 2S2O32-+2H+=SO42-+3S↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
4.以下说法正确的是( )
| A. | 金属元素与非金属元素的原子间只形成离子键 | |
| B. | 原子或离子间相互的吸引力叫化学键 | |
| C. | 非金属元素间只能形成共价键 | |
| D. | 共价化合物内部可能有极性键和非极性键 |
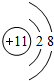 ,D元素位于周期表中的位置第三周期第ⅤⅡA族.
,D元素位于周期表中的位置第三周期第ⅤⅡA族.