��Ŀ����
�������������Ṥҵ�Ļ�������ij����������ֻ��������Ӧ�ٺ���Ӧ��
4NH3 (g)+5O2(g) 4NO(g)+6H2O(g) ��H= -905kJ/mol ��
4NO(g)+6H2O(g) ��H= -905kJ/mol ��
4NH3 (g)+3O2(g) 2N2 (g)+6H2O(g) ��H= -1268kJ/mol ��
2N2 (g)+6H2O(g) ��H= -1268kJ/mol ��
����˵����ȷ����
4NH3 (g)+5O2(g)
 4NO(g)+6H2O(g) ��H= -905kJ/mol ��
4NO(g)+6H2O(g) ��H= -905kJ/mol �� 4NH3 (g)+3O2(g)
 2N2 (g)+6H2O(g) ��H= -1268kJ/mol ��
2N2 (g)+6H2O(g) ��H= -1268kJ/mol �� ����˵����ȷ����
[ ]
A����ҵ�Ͻ��а�����������NOʱ���¶�Ӧ������780��840��֮��
B����ҵ�ϲ������ϱ�n(O2)/n(NH3)��1.7��2.0����Ҫ��Ϊ����߷�Ӧ����
C���ڼ�ѹ�������������������5��6��������Ϊ��ѹ�����ת����
D����������ΪNO���Ȼ�ѧ����ʽΪ��N2(g)+O2(g) 2NO(g) ��H =+181. 5kJ/mol
2NO(g) ��H =+181. 5kJ/mol
B����ҵ�ϲ������ϱ�n(O2)/n(NH3)��1.7��2.0����Ҫ��Ϊ����߷�Ӧ����
C���ڼ�ѹ�������������������5��6��������Ϊ��ѹ�����ת����
D����������ΪNO���Ȼ�ѧ����ʽΪ��N2(g)+O2(g)
 2NO(g) ��H =+181. 5kJ/mol
2NO(g) ��H =+181. 5kJ/mol AD

��ϰ��ϵ�д�
�����Ŀ
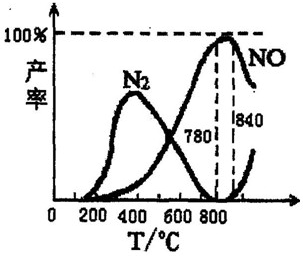 �������������Ṥҵ�Ļ�������ij����������ֻ��������Ӧ�ٺ���Ӧ�ڣ��й����ʲ������¶ȵĹ�ϵ��ͼ��
�������������Ṥҵ�Ļ�������ij����������ֻ��������Ӧ�ٺ���Ӧ�ڣ��й����ʲ������¶ȵĹ�ϵ��ͼ����4NH3��g��+5O2��g��?4NO��g��+6H2O��g����H=-905kJ/mol
��4NH3��g��+3O2��g��?2N2��g��+6H2O��g����H=-1268kJ/mol
����˵���в���ȷ���ǣ�������
| A��N2��g��+O2��g��?2NO��g������H=+181.5 kJ/mol | B����ѹ������NH3����NO��������NH3����N2 | C����ҵ�ϰ�����������NOʱ���¶�Ӧ������780��840��֮�� | D����ҵ��ͨ�����������Ũ�ȣ������NH3��ת���� |
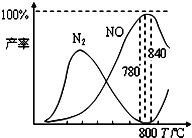 ��2012?̫ԭһģ���������������Ṥҵ�Ļ�������ij����������ֻ�������¢�����Ӧ�͢ڸ���Ӧ��
��2012?̫ԭһģ���������������Ṥҵ�Ļ�������ij����������ֻ�������¢�����Ӧ�͢ڸ���Ӧ�� �������������Ṥҵ�Ļ�������ij����������ֻ��������Ӧ�ٺ���Ӧ�ڣ��й����ʲ������¶ȵĹ�ϵ��ͼ��4NH3��g��+5O2��g��?4NO��g��+6H2O��g����H=-905kJ?mol-1 ��4NH3��g��+3O2��g��?2N2��g��+6H2O��g����H=-1268kJ?mol-1 ������˵������ȷ���ǣ�������
�������������Ṥҵ�Ļ�������ij����������ֻ��������Ӧ�ٺ���Ӧ�ڣ��й����ʲ������¶ȵĹ�ϵ��ͼ��4NH3��g��+5O2��g��?4NO��g��+6H2O��g����H=-905kJ?mol-1 ��4NH3��g��+3O2��g��?2N2��g��+6H2O��g����H=-1268kJ?mol-1 ������˵������ȷ���ǣ������� �������������Ṥҵ�Ļ�������ij����������ֻ��������Ӧ�ٺ���Ӧ�ڣ��й����ʲ������¶ȵĹ�ϵ����ͼ��
�������������Ṥҵ�Ļ�������ij����������ֻ��������Ӧ�ٺ���Ӧ�ڣ��й����ʲ������¶ȵĹ�ϵ����ͼ��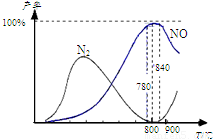
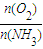 ��1.7��2.0����Ҫ��Ϊ����߷�Ӧ����
��1.7��2.0����Ҫ��Ϊ����߷�Ӧ����