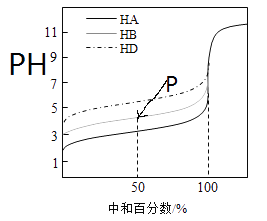
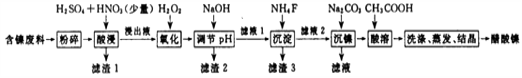
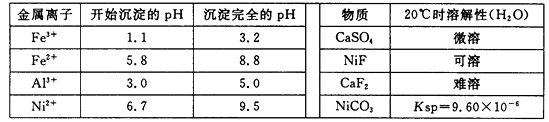
题目内容
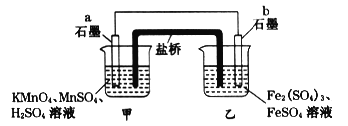
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法不正确的是( )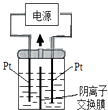
A.右侧发生的电极反应式:2H2O+2e-=H2↑+2OH-
B.电解结束后,右侧溶液中含有IO3-
C.电解槽内发生反应的总化学方程式:KI+3H2O=KIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变。
【答案】D
【解析】A.左侧溶液变蓝色,生成I2 , 左侧电极为阳极,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH- , 发生还原反应,A不符合题意;
B.一段时间后,蓝色变浅,发生反应3I2+6OH-=IO3-+5I-+3H2O,中间为阴离子交换膜,右侧I-、OH-通过阴离子交换膜向左侧移动,保证两边溶液呈电中性,左侧的IO3-通过阴离子交换膜向右侧移动,故右侧溶液中含有IO3- , B不符合题意;
C.左侧电极为阳极,电极反应为:2I--2e-=I2 , 同时发生反应3I2+6OH-=IO3-+5I-+3H2O,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH- , 故总的电极反应式为:KI+3H2O ![]() KIO3+3H2↑,C不符合题意;
KIO3+3H2↑,C不符合题意;
D.如果用阳离子交换膜代替阴离子交换膜,左侧电极为阳极,电极反应为:2I--2e-=I2 , 右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH- , 保证两边溶液呈电中性,左侧多余K+通过阳离子交换膜迁移至阴极,左侧生成I2 , 右侧溶液中有KOH生成,碘单质与KOH不能反应,总反应相当于:2KI+2H2O ![]() 2KOH+I2+H2↑,D符合题意。答案选D。根据实验现象判断电极发生的反应类型,结合电解原理进行分析电解池中发生的反应即可.
2KOH+I2+H2↑,D符合题意。答案选D。根据实验现象判断电极发生的反应类型,结合电解原理进行分析电解池中发生的反应即可.

【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g) ![]() 2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:下列说法不正确的是( )
2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:下列说法不正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 012 | 011 | 010 | 010 |
A.反应前2min的平均速率v(Z)=2.0×10-5mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C.该温度下此反应的平衡常数:K=1.44
D.保持其他条件不变,起始时向容器充入0.32mol气体X和0.32mol气体Y,到达平衡时,n(Z)=0.024mol