题目内容
铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为________g.
答案:
解析:
提示:
解析:
|
8.51 【巧解导析】失电子Cu Mg 1mol 34g 1mol 34g 所以最终沉淀质量为:4.6+Δm增=4.6+0.115×34=8.51g. |
提示:
|
【巧解点悟】解题关键点:利用得失电子总数相等求出合金总的物质的量,然后找出起始物和最终物的差量关系,利用差量法,求出增加的质量.易错点:易算出铜、镁各自的物质的量,分步的计算繁琐易出错. |

练习册系列答案
相关题目
铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mlN2O4(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为( )。
| A.8.51g | B.8.26g | C.7.04g | D.9.02g |
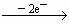 Cu2+,Mg
Cu2+,Mg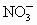
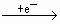 NO2,
NO2,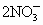
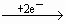 N2O4.根据得失电子总数相等,则可求出Cu,Mg总的物质的量为:n(总)×2=
N2O4.根据得失电子总数相等,则可求出Cu,Mg总的物质的量为:n(总)×2=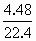 ×1+
×1+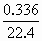 ×2,n(总)=0.115mol,起如物同最终物的关系为:
×2,n(总)=0.115mol,起如物同最终物的关系为: Mg(OH)2 Δm增 Cu
Mg(OH)2 Δm增 Cu