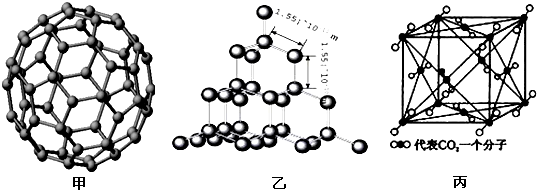
题目内容
[化学——选修有机化学基础](30分)
Ⅰ.(18分)请选出下列各题中符合题意的选项:
(1)下列不可能存在的有机物是
A.2—甲基丙烷 B.2,3—二氯—2,2—二甲基戊烷
C.3—溴—3—乙基戊烷 D.2,2,3,3—四甲基丁烷
(2)能在KOH的醇溶液中发生消去反应的是

(3)某有机物既能发生氧化反应,又能发生还原反应,且氧化产物和还原产物能发生酯化反应,所生成的酯也能发生银镜反应。则该有机物的结构简式是
A.CH3OH B.HCHO
C.HCOOH D.HCOOCH3
Ⅱ.(12分)有机物A的结构简式为:

据此回答下列问题:
(1)A的分子式为__________。
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物。当有1 mol A发生反应时,最多消耗 mol NaOH。
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构简式为 。
(4)写出苯环上只有一个取代基且属于酯类的D的所有同分异构体的结构简式: 。
Ⅰ.(18分)(1)B (2)C (3)B (每题6分)
Ⅱ.(12分)
(1)C12H13O4Cl (2分)(2)3(2分)(3)  (2分)
(2分)
(4) (各2分)
(各2分)
【解析】Ⅰ.(1)由于碳原子的价电子是4个,所以碳原子不可能形成5个共价键,B不正确。其余都是正确的,答案选B。
(2)卤代烃发生消去反应的条件是与卤素原子连接的碳原子的邻位碳原子必须含有氢原子,据此可判断选项C可发生消去反应,答案选C。
(3)能发生银镜反应的酯一定是甲酸形成的酯,所以该有机物是甲醛,答案选B。
Ⅱ.(1)根据A结构简式并根据碳原子的价电子数可知,分子式为C12H13O4Cl。
(2)A中含有1个羧基、1个氯原子和1个酯基,因此需要3mol氢氧化钠。
(3)A在氢氧化钠的溶液中加热,发生水解反应,生成物分别是HOOC CH2CHOHCH2OH和 。由于D是芳香族化合物,所以B是HOOC CH2CHOHCH2OH。B中含有羧基和羟基,可发生分子内的酯化反应,所以形成的五元环酯是
。由于D是芳香族化合物,所以B是HOOC CH2CHOHCH2OH。B中含有羧基和羟基,可发生分子内的酯化反应,所以形成的五元环酯是 。
。
(4)属于酯类,石墨必须含有酯基,所以根据D的结构简式 可知,其同分异构体有
可知,其同分异构体有 。
。





 [化学选修3:物质结构与性质]
[化学选修3:物质结构与性质]