题目内容
高铁电池的总反应为:3Zn+2K2FeO4+8H2O

3Zn(OH)2+2Fe(OH)3+4KOH 下列叙述错误的是( )

3Zn(OH)2+2Fe(OH)3+4KOH 下列叙述错误的是( )
| A.放电时每转移6mol电子,负极有2mol K2FeO4被还原 |
| B.充电时阴极反应为:Zn(OH)2+2e-=Zn+2OH- |
| C.放电时正极反应为:FeO42-+3e-+4H2O=Fe(OH)3+5OH- |
| D.充电时阳极附近溶液的碱性增强 |
A、高铁电池放电时,锌元素的化合价升高,每转移6mol电子,在正极上有2mol K2FeO4被还原,故A错误;
B、充电时阴极3Zn(OH)2发生得电子得还原反应,即Zn(OH)2+2e-=Zn+2OH-,故B正确;
C、放电时正极K2FeO4发生得电子的还原反应,即FeO42-+3e-+4H2O=Fe(OH)3+5OH-,故C正确;
D、充电时阳极附近2Fe(OH)3发生失电子的氧化反应,即Fe(OH)3+5OH--3e-=FeO42-+4H2O,消耗氢氧根离子,所以碱性减弱,故D错误.
故选AD.
B、充电时阴极3Zn(OH)2发生得电子得还原反应,即Zn(OH)2+2e-=Zn+2OH-,故B正确;
C、放电时正极K2FeO4发生得电子的还原反应,即FeO42-+3e-+4H2O=Fe(OH)3+5OH-,故C正确;
D、充电时阳极附近2Fe(OH)3发生失电子的氧化反应,即Fe(OH)3+5OH--3e-=FeO42-+4H2O,消耗氢氧根离子,所以碱性减弱,故D错误.
故选AD.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
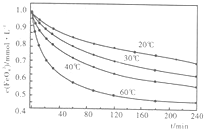 (2010?安徽模拟)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新型、高效、绿色环保的多功能水处理剂.近十几年来,我国对高铁酸钾在饮用水处理中的应用的研究也不断深入,已取得可喜成果.比较理想的制备方法是次氯酸盐氧化法:先向KOH溶液中通入足量Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾.
(2010?安徽模拟)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新型、高效、绿色环保的多功能水处理剂.近十几年来,我国对高铁酸钾在饮用水处理中的应用的研究也不断深入,已取得可喜成果.比较理想的制备方法是次氯酸盐氧化法:先向KOH溶液中通入足量Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾.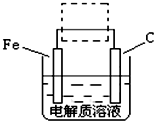 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH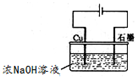 溶液的pH为
溶液的pH为