题目内容
17.H2和I2在一定条件下能发生反应:H2(g)+I2(g)═2HI(g)△H=-a kJ•mol-1已知: (a、b、c均大于零)下列说法不正确的是( )
(a、b、c均大于零)下列说法不正确的是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量 | |
| C. | 断开2 mol H-I键所需能量约为(c+b+a) kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ |
分析 A、依据反应是放热反应,结合能量守恒分析;
B、断裂化学键吸收能量,形成化学键放出能量,结合反应是放热反应分析判断;
C、依据焓变=反应物断裂化学键需要的能量-生成物形成化学键放出的能量分析判断;
D、反应是可逆反应不能进行彻底.
解答 解:A、H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-a kJ•mol-1 ,反应是放热反应,反应物能量高于生成物,故A正确;
B、断裂化学键吸收能量,形成化学键放出能量,反应是放热反应所以形成化学键放出的能量大于断裂化学键吸收的能量,断开1mol H-H键和1mol I-I键所需能量小于断开2mol H-I键所需能量,故B错误;
C、△H=反应物断裂化学键需要的能量-生成物形成化学键放出的能量=bKJ/mol+cKJ/mol-2H-I=-aKJ/mol,得到断开2mol H-I键所需能量约为(a+b+c)KJ,故C正确;
D、反应是可逆反应不能进行彻底,依据焓变意义分析,向密闭容器中加入2mol H2和2mol I2,充分反应后放出的热量小于2a kJ,故D正确;
故选B.
点评 本题考查了化学反应的焓变分析,化学键与焓变关系的计算分析应用,掌握原理和基础是解题关键,题目难度中等.

练习册系列答案
相关题目
5.普通干电池两极材料是锌和石墨棒,两极间为MnO2、NH4Cl、ZnCl2糊状物,下列说法错误的是( )
| A. | 干电池中锌作负极,石墨棒作正极 | |
| B. | 负极发生还原反应:Zn-2e-═Zn2+ | |
| C. | MnO2的作用是把正极附近生成的氢气氧化成水,避免氢气泡出现 | |
| D. | 干电池工作时,由化学能转变为电能 |
2.已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如表,下列叙述正确的是( )
| 酸 | 电离平衡常数 |
| 醋酸 | Ki=1.75×10-5 |
| 次氯酸 | Ki=2.98×10-8 |
| 碳酸 | Ki1=4.30×10-7Ki2=5.61×10-11 |
| 亚硫酸 | Ki1=1.54×10-2 Ki2=1.02×10-7 |
| A. | 将0.1 mol•L-1的醋酸加水不断稀释,c(OH-)始终减小 | |
| B. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| D. | 25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 |
9.常温下,下列说法中,正确的是( )
| A. | 0.1mol/L的HNO3溶液中由水电离出的c(H+)<$\sqrt{{K}_{W}}$ | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-amol/L,若a<7,则pH一定为a | |
| C. | 在小苏打水溶液中存在的电离平衡有:NaHCO3?Na++HCO3-,HCO3-?CO32-+H+,H2O?H++OH- | |
| D. | NH3•H2O和NH4Cl混合液pH=7,则c(NH4+)=c(NH3•H2O)>c(H十)=c(OH-) |
6.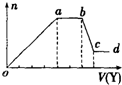 某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
(1)若Y是盐酸,则X中一定含有的离子是CO32-、SiO32-、AlO2-、Na+,oa段发生反应的离子方程式SiO32-+2H+═H2SiO3↓、AlO2-+H++H2O═Al(OH)3↓,(指来源于X溶液的,下同) ab段发生反应的离子方程式CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,bc段发生反应的离子方程式Al(OH)3+3H+═Al3++3H2O.
(2)若Y是NaOH溶液,则X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-,则oa段转化为沉淀的离子是Al3+、Mg2+,ab段反应的离子方程式为NH4++OH-═MH3•H2O.bc段反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
 某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.| 阴离子 | CO32-、Si32-、AlO2-、Cl- |
| 氧离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
(2)若Y是NaOH溶液,则X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-,则oa段转化为沉淀的离子是Al3+、Mg2+,ab段反应的离子方程式为NH4++OH-═MH3•H2O.bc段反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
7.下列有关实验操作的叙述中,错误的是( )
| A. | 实验室用排水集气法收集氧气完毕,把导管从水中取出,然后移去酒精灯 | |
| B. | 氢气还原氧化铜的实验结束,先移去酒精灯,待试管冷却后再停止通氢气 | |
| C. | 倾倒液体进行过滤时,应使液体沿着玻璃棒流下,且液面低于滤纸边缘 | |
| D. | 因NaOH有腐蚀性,可在天平两托盘上放同样的滤纸后再放NaOH,然后进行称量 |