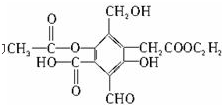
题目内容
14.常温下(I)100mL0.1mol/L的NaA溶液中的离子总物质的量为X,(Ⅱ)100mL 0.1mol/L的NaB溶液中的离子总物质的量为Y.下列推断正确的是( )| A. | 若X>Y,则酸性:HA>HB | |
| B. | 若X=Y,则HB一定是强酸 | |
| C. | 若酸性:HA<HB,则X和Y关系不确定 | |
| D. | 若由水电离出的H+的浓度:(I)>(Ⅱ),则是X>Y |
分析 两种溶液中n(NaA)=n(NaB),溶液中存在c(Na+)+c(H+)=c(A-)+c(OH-)、c(Na+)+c(H+)=c(B-)+c(OH-),两种溶液中钠离子都不水解,所以钠离子浓度相等,根据氢离子浓度判断溶液中总离子浓度;
A.若X>Y,NaA中c(H+)大于NaB溶液中c(H+),c(H+)越大说明酸根离子水解能力越小;
B.若X=Y,说明两种溶液中c(H+)浓度相等,则两种酸可能都是强酸,也可能都是弱酸但酸性相同;
C.若酸性:HA<HB,酸性越强,其酸根离子水解程度越弱,相同浓度、相同体积的钠盐溶液中氢离子物质的量越少;
D.弱离子能促进水电离,弱离子越弱,其促进水电离程度越大.
解答 解:两种溶液中n(NaA)=n(NaB),溶液中存在c(Na+)+c(H+)=c(A-)+c(OH-)、c(Na+)+c(H+)=c(B-)+c(OH-),两种溶液中钠离子都不水解,所以钠离子浓度相等,根据氢离子浓度判断溶液中总离子浓度;
A.若X>Y,NaA中c(H+)大于NaB溶液中c(H+),c(H+)越大说明溶液碱性越弱,则酸根离子水解能力越小,所以酸性HA>HB,故A正确;
B.若X=Y,说明两种溶液中c(H+)浓度相等,则两种酸可能都是强酸,也可能都是弱酸但酸性相同,则HB不一定是强酸,故B错误;
C.若酸性:HA<HB,酸性越强,其酸根离子水解程度越弱,相同浓度、相同体积的钠盐溶液中氢离子物质的量越少,所以若酸性:HA<HB,水解程度A->B-,NaA溶液碱性大于NaB,所以NaA中氢离子浓度大于NaB,所以X大于Y,故C错误;
D.弱离子能促进水电离,弱离子越弱,其促进水电离程度越大,若由水电离出的H+的浓度:(I)>(Ⅱ),则酸性HA>HB,酸根离子水解程度A-<B-,溶液碱性NaA>NaB,所以X<Y,故D错误;
故选A.
点评 本题以盐类水解为载体考查离子浓度大小比较,侧重考查学生分析判断能力,要判断溶液中总离子物质的量要根据溶液中氢离子浓度判断,根据c(Na+)+c(H+)=c(A-)+c(OH-)、c(Na+)+c(H+)=c(B-)+c(OH-)进行分析判断,注意溶液中离子总浓度是总阴离子或阳离子的2倍,题目难度中等.

| A. | NCl3的电子式: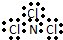 | B. | H- 的结构示意图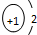 | ||
| C. | 含有4个中子的锂原子:74Li | D. | 次氯酸的结构式:H-Cl-O |
| A. | 甲苯硝化生成三硝基甲苯 | B. | 甲苯能使酸性高锰酸钾溶液褪色 | ||
| C. | 甲苯燃烧带有浓厚的黑烟 | D. | 甲苯与氢气可以生加成反应 |

| A. | 发生水解反应时,被破坏的键是①和③ | |
| B. | 发生消去反应时,被破坏的键是①和③ | |
| C. | 发生水解反应时,被破坏的键是③ | |
| D. | 发生消去反应时,被破坏的键是①和② |
①能与酸反应的氧化物,一定是碱性氧化物
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
④过氧化氢和液氮的分子中都有非极性共价键
⑤NF3的沸点比NH3的沸点低是因为N-F比N-H键的键能大
⑥在熔化状态和水溶液中均不能导电的物质称为非电解质.
| A. | 只有①②⑥ | B. | 只有③⑥ | C. | 只有③④ | D. | 只有⑤⑥ |
①B+H2O $\stackrel{电解}{→}$ C+H2↑ ②A→B+NaCl ③E+NaOH→B+C+H2O ④D+NaOH→A+B+H2O
这五种化合物中含氯的化合价由高到低的顺序为( )
| A. | C、B、E、D、A | B. | B、D、A、C、E | C. | C、D、E、A、B | D. | C、E、B、D、A |
| A. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 | |
| B. | 使用高效催化剂可有效提高正反应速率 | |
| C. | 反应达到平衡后,NO的反应速率保持恒定 | |
| D. | 升高温度可使该反应的逆反应速率降低 |