题目内容
 如图为元素周期表短周期的一部分.关于A~G七种元素的叙述正确的是( )
如图为元素周期表短周期的一部分.关于A~G七种元素的叙述正确的是( )分析:图为元素周期表短周期的一部分,根据元素在周期表中的位置,可推断出A为C元素,B为N元素,C为O元素,D为F元素,E为S元素,F为Cl元素,G为Ar元素,
A.根据单质的类型判断是否存在共价键;
B.电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大;
C.非金属性越强氢化物越稳定,同周期自左而右非金属性增强;
D.根据氢化物的与硝酸的性质判断是否能发生化合反应.
A.根据单质的类型判断是否存在共价键;
B.电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大;
C.非金属性越强氢化物越稳定,同周期自左而右非金属性增强;
D.根据氢化物的与硝酸的性质判断是否能发生化合反应.
解答:解:图为元素周期表短周期的一部分,根据元素在周期表中的位置,可推断出A为C元素,B为N元素,C为O元素,D为F元素,E为S元素,F为Cl元素,G为Ar元素,
A.E、F、G形成的单质分别为:S、Cl2、Ar,Ar为单原子分子,不存在共价键,故A错误;
B.C、D、E的阴离子分别为:O2-、F-、S2-,其中O2-、F-核外有2个电子层,S2-有3个电子层,则S2-半径大于O2-、F-,根据核外电子排布相同的离子,核电核数越大半径越小判断离子半径,则有O2->F-,故S2->O2->F-,故B正确;
C.元素的非金属性越强,对应氢化物的稳定性就越大,非金属性B<C<D,B、C、D三种元素的氢化物的稳定性依次增强,故C错误;
D.A、B、E的氢化物分别是CH4、NH3、H2S,只有NH3能与硝酸化合,故D错误;
故选B.
A.E、F、G形成的单质分别为:S、Cl2、Ar,Ar为单原子分子,不存在共价键,故A错误;
B.C、D、E的阴离子分别为:O2-、F-、S2-,其中O2-、F-核外有2个电子层,S2-有3个电子层,则S2-半径大于O2-、F-,根据核外电子排布相同的离子,核电核数越大半径越小判断离子半径,则有O2->F-,故S2->O2->F-,故B正确;
C.元素的非金属性越强,对应氢化物的稳定性就越大,非金属性B<C<D,B、C、D三种元素的氢化物的稳定性依次增强,故C错误;
D.A、B、E的氢化物分别是CH4、NH3、H2S,只有NH3能与硝酸化合,故D错误;
故选B.
点评:本题考查元素的推断以及物质的化学键、离子半径比较、氢化物的稳定和物质的性质,本题难度不大,根据元素在周期表中的位置进行推断是本题的关键.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
 四种短周期元素在元素周期表中的位置如图所示,同周期中Z的原子半径最小.下列说法正确的是( )
四种短周期元素在元素周期表中的位置如图所示,同周期中Z的原子半径最小.下列说法正确的是( )| A、M元素一定为金属元素 | B、X元素的最简单气态氢化物的热稳定性比Z元素的大 | C、Y元素存在最高价含氧酸,其酸性比X元素的最高价含氧酸弱 | D、Z元素与氢元素一定能形成原子个数比为1:1的共价化合物 |




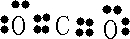
 H++Cl-+HClO
H++Cl-+HClO
