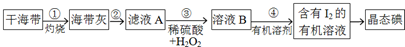
题目内容
18.配置240mL1.84mol•L-1稀硫酸,下列操作正确的是( )| A. | 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却 | |
| B. | 必须的定量仪器有100mL量筒、250mL容量瓶和托盘天平 | |
| C. | 量取质量分数为98%的浓硫酸(ρ=1.84g•cm-3)的体积为25.0mL | |
| D. | 先在容量瓶中加入适量水,将量好的浓硫酸注入容器瓶加入定容 |
分析 A、浓硫酸稀释放热;
B、由于无240mL容量瓶且容量瓶只有一条刻度线,故应选用250mL容量瓶,配置出250mL溶液,由于配置稀硫酸的原料是浓硫酸,故选用量筒来量取浓硫酸;
C、求出浓硫酸的物质的量浓度,然后根据稀释定律来计算需要的体积;
D、浓硫酸的稀释不能在容量瓶中进行.
解答 解:A、浓硫酸稀释放热,故为了防止浓硫酸外溅,应将浓硫酸注入水中,故A错误;
B、由于无240mL容量瓶且容量瓶只有一条刻度线,故应选用250mL容量瓶,配置出250mL溶液,由于配置稀硫酸的原料是浓硫酸,故选用量筒来量取浓硫酸,不需要天平,故B错误;
C、浓硫酸的物质的量浓度C=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要的浓硫酸的体积为VmL,根据稀释定律可知:18.4mol/L×VmL=250mL×1.84mol•L-1,解得V=25mL,故C正确;
D、浓硫酸稀释放热,而容量瓶不能受热,故浓硫酸的稀释不能在容量瓶中进行,故D错误.
故选C.
点评 本题考查了配置一定物质的量浓度的溶液的时候的仪器的选择和操作,应注意的是不能在容量瓶中稀释溶液,难度不大.

练习册系列答案
相关题目
8.通常状况下能共存,且能用碱石灰干燥的一组气体是( )
| A. | H2,N2,SO2 | B. | H2,N2,O2 | C. | HCl,NO2,NH3 | D. | O2,NO2,NO |
13.向3支盛有少量Mg(OH)2沉淀的试管中分别滴加适量的蒸馏水,盐酸和氯化铵溶液,观察并记录现象,并写出实验中有关反应的化学方程式.
| 滴加试剂 | 蒸馏水 | 盐酸 | 氯化铵溶液 |
| 现象 |
3.在pH=9的NaOH溶液和CH3COONa溶液中,水电离的OH-浓度分别为M mol/L和N mol/L,M和N的关系为( )
| A. | M>N | B. | M=10-4N | C. | N=10-4M | D. | M=N |
7.二氧化硫能使溴水褪色,说明二氧化硫具有( )
| A. | 还原性 | B. | 氧化性 | C. | 漂白性 | D. | 酸性 |
7.将一定量铁粉和铜粉的混合物加入由稀硫酸和稀硝酸组成的混合溶液中,充分反应后金属粉末有剩余,下列有关推断正确的是( )
| A. | 反应过程中不可能产生H2 | |
| B. | 剩余的金属粉末中一定有铜 | |
| C. | 往反应后的溶液中加入KSCN 溶液会变血红色 | |
| D. | 往反应后的溶液中加入足量的稀H2SO4,则金属粉末的质量一定会减少 |
 某宝石的主要成分是Al2O3,其中混有少量Mg、Ti、Fe等杂质而使其呈蓝色.
某宝石的主要成分是Al2O3,其中混有少量Mg、Ti、Fe等杂质而使其呈蓝色.