题目内容
欲用18.4mol/L的浓硫酸配制浓度为0.5mol?L-1的稀硫酸500ml.
(1)①选用的主要仪器有:量筒、烧杯、 、 、胶头滴管.②所需浓硫酸的体积为 mL;
(2)在下列各操作中正确的序号是
A.用量筒量取浓H2SO4B.反复颠倒摇匀 C.用胶头滴管加蒸馏水至刻度线 D.洗涤烧杯和玻璃棒并转入容量瓶 E.将浓硫酸稀释后冷却F.将溶液转入容量瓶.
(3)在配制过程中将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌,若搅拌过程中有液体溅出结果会使浓度偏 ;(填“高”、“低”或“无影响”,下同)定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度偏 .
(1)①选用的主要仪器有:量筒、烧杯、
(2)在下列各操作中正确的序号是
A.用量筒量取浓H2SO4B.反复颠倒摇匀 C.用胶头滴管加蒸馏水至刻度线 D.洗涤烧杯和玻璃棒并转入容量瓶 E.将浓硫酸稀释后冷却F.将溶液转入容量瓶.
(3)在配制过程中将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌,若搅拌过程中有液体溅出结果会使浓度偏
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)根据配制一定物质的量浓度的溶液使用的仪器进行分析;根据溶液稀释过程中溶质硫酸的物质的量不变计算出需要浓硫酸的体积;
(2)根据配制一定物质的量的浓度溶液的方法进行排序;
(2)根据c=
分析操作对溶质的物质的量或对溶液的体积的影响判断;
(2)根据配制一定物质的量的浓度溶液的方法进行排序;
(2)根据c=
| n |
| V |
解答:
解:(1)配制0.5mol?L-1的稀硫酸500ml,使用的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还需要的仪器为:500mL容量瓶、玻璃棒,
配制0.5mol?L-1的稀硫酸500ml,溶液中含有的溶质硫酸的物质的量为:0.5mol?L-1×0.5L=0.25mol,需要浓度为18.4mol?L-1的浓硫酸体积为:
=0.01358L=13.6mL,
故答案为:500mL容量瓶、玻璃棒;13.6,
(2)配制步骤为:量取浓硫酸、浓硫酸的稀释、转移、定容、摇匀、转入试剂瓶,所以正确顺序为:AEFDCB,故答案为:AEFDCB;
(3)在配制过程中将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌,若搅拌过程中有液体溅出,会导致溶质硫酸的物质的量偏低,配制的溶液浓度偏低;
定容时必须使溶液凹液面与刻度线相切,若俯视,溶液的体积偏小,会使浓度偏高;
故答案为:低;高;
配制0.5mol?L-1的稀硫酸500ml,溶液中含有的溶质硫酸的物质的量为:0.5mol?L-1×0.5L=0.25mol,需要浓度为18.4mol?L-1的浓硫酸体积为:
| 0.25mol |
| 18.4mol/L |
故答案为:500mL容量瓶、玻璃棒;13.6,
(2)配制步骤为:量取浓硫酸、浓硫酸的稀释、转移、定容、摇匀、转入试剂瓶,所以正确顺序为:AEFDCB,故答案为:AEFDCB;
(3)在配制过程中将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌,若搅拌过程中有液体溅出,会导致溶质硫酸的物质的量偏低,配制的溶液浓度偏低;
定容时必须使溶液凹液面与刻度线相切,若俯视,溶液的体积偏小,会使浓度偏高;
故答案为:低;高;
点评:本题考查一定物质的量浓度溶液配制过程、物质的量浓度有关计算和误差分析等,难度不大,误差分析为易错点.

练习册系列答案
相关题目
 科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振氢谱表明其分子中的氢原子所处的化学环境没有区别,根据分析,绘制了该分子的球棍模型如图所示,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振氢谱表明其分子中的氢原子所处的化学环境没有区别,根据分析,绘制了该分子的球棍模型如图所示,下列说法中不正确的是( )| A、该分子的分子式为C5H4 |
| B、该分子中碳原子的化学环境有2种 |
| C、1mol X在一定条件下可与2mol H2发生反应 |
| D、该分子中只有C-C键,没有C═C键 |
下列与化学概念有关的说法正确的是( )
| A、化合反应均为氧化还原反应 |
| B、催化剂能改变可逆反应达到平衡的时间 |
| C、金属氧化物均为碱性氧化物 |
| D、石油是混合物,其分馏产品汽油为纯净物 |
下列关于范德华力的叙述中,正确的是( )
| A、范德华力的实质也是一种电性作用,所以范德华力是一种特殊化学键 |
| B、任何分子间在任意情况下都会产生范德华力 |
| C、范德华力与化学键的区别是作用力的强弱问题 |
| D、范德华力非常微弱,故破坏范德华力不需要消耗能量 |
 研究控制汽车尾气成为保护环境的重要任务.汽车内燃机工作时发生反应:
研究控制汽车尾气成为保护环境的重要任务.汽车内燃机工作时发生反应: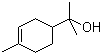 )的分子式为
)的分子式为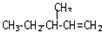 一定条件发生加聚反应时的化学方程式
一定条件发生加聚反应时的化学方程式 A、B、C、D、E为短周期元素且原子序数依次增大,其中A含有3个能级且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强.
A、B、C、D、E为短周期元素且原子序数依次增大,其中A含有3个能级且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强.