题目内容
9.5gMgCl2固体溶于水配成500mL溶液,其浓度为________mol?L-1,从中取出100mL溶液,其中Cl-的浓度为________mol?L-1;再把取出的溶液加水稀释成500mL,则此时MgCl2溶液的浓度为________mol?L-1.
0.2 0.4 0.04
分析:根据n= 计算9.5gMgCl2的物质的量,再根据c=
计算9.5gMgCl2的物质的量,再根据c= 计算氯化镁溶液的浓度;
计算氯化镁溶液的浓度;
溶液是均匀的,从中取出100mL溶液,其中Cl-的浓度与原溶液相同,溶液中c(Cl-)=2c(MgCl2);
根据稀释定律,稀释前后氯化镁的物质的量不变,据此计算稀释后MgCl2溶液的浓度.
解答:9.5gMgCl2的物质的量= =0.1mol,故氯化镁溶液的浓度为
=0.1mol,故氯化镁溶液的浓度为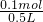 =0.2mol/L;
=0.2mol/L;
溶液是均匀的,从中取出100mL溶液,其中Cl-的浓度与原溶液相同,溶液中c(Cl-)=2c(MgCl2)=2×0.2mol/L=0.4mol/L;
根据稀释定律,稀释前后氯化镁的物质的量不变,令稀释后MgCl2溶液的浓度为cmol/L,则:
0.2mol/L×100mL=cmol/L×500mL,解得c=0.04,
故答案为:0.2; 0.4; 0.04.
点评:本题考查物质的量浓度的有关计算,比较基础,注意对公式的理解与灵活运用.
分析:根据n=
 计算9.5gMgCl2的物质的量,再根据c=
计算9.5gMgCl2的物质的量,再根据c= 计算氯化镁溶液的浓度;
计算氯化镁溶液的浓度;溶液是均匀的,从中取出100mL溶液,其中Cl-的浓度与原溶液相同,溶液中c(Cl-)=2c(MgCl2);
根据稀释定律,稀释前后氯化镁的物质的量不变,据此计算稀释后MgCl2溶液的浓度.
解答:9.5gMgCl2的物质的量=
 =0.1mol,故氯化镁溶液的浓度为
=0.1mol,故氯化镁溶液的浓度为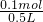 =0.2mol/L;
=0.2mol/L;溶液是均匀的,从中取出100mL溶液,其中Cl-的浓度与原溶液相同,溶液中c(Cl-)=2c(MgCl2)=2×0.2mol/L=0.4mol/L;
根据稀释定律,稀释前后氯化镁的物质的量不变,令稀释后MgCl2溶液的浓度为cmol/L,则:
0.2mol/L×100mL=cmol/L×500mL,解得c=0.04,
故答案为:0.2; 0.4; 0.04.
点评:本题考查物质的量浓度的有关计算,比较基础,注意对公式的理解与灵活运用.

练习册系列答案
相关题目