题目内容
在一个固定体积为2升的密闭容器中,充入2mol A和1mol B,发生如下反应:2A(g)+B(g)?3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2mol/L.
(1)写出该反应平衡常数的表达式
,2分钟内B 的平均反应速度为
(2)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为
(3)若将容器体积缩小至1升,反应达到平衡时C的浓度为
(1)写出该反应平衡常数的表达式
| c3(C) |
| c2(A)c(B) |
| c3(C) |
| c2(A)c(B) |
0.2mol/(L.min)
0.2mol/(L.min)
(2)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为
吸热
吸热
(填“吸热”或“放热”)反应.(3)若将容器体积缩小至1升,反应达到平衡时C的浓度为
2.4
2.4
mol/L′,平衡常数不变
不变
(填增大、减小或不变)分析:2分钟反应达到平衡,此时C的浓度为1.2mol/L,则
2A(g)+B(g)?3C(g)+D(s),
开始 1 0.5 0
转化0.8 0.4 1.2
平衡0.2 0.1 1.2
(1)K为生成物浓度幂之积与反应物浓度幂之积的比,结合反应速率与化学计量数之比计算;
(2)温度升高,平衡时混合气体的平均相对摩尔质量减小,D为固体,正向移动,气体质量减小,平衡正向移动;
(3)将容器体积缩小至1升,平衡不移动,C的浓度为原来的2倍,温度不变,平衡常数不变.
2A(g)+B(g)?3C(g)+D(s),
开始 1 0.5 0
转化0.8 0.4 1.2
平衡0.2 0.1 1.2
(1)K为生成物浓度幂之积与反应物浓度幂之积的比,结合反应速率与化学计量数之比计算;
(2)温度升高,平衡时混合气体的平均相对摩尔质量减小,D为固体,正向移动,气体质量减小,平衡正向移动;
(3)将容器体积缩小至1升,平衡不移动,C的浓度为原来的2倍,温度不变,平衡常数不变.
解答:解:2分钟反应达到平衡,此时C的浓度为1.2mol/L,则
2A(g)+B(g)?3C(g)+D(s),
开始 1 0.5 0
转化0.8 0.4 1.2
平衡0.2 0.1 1.2
(1)K=
,C的反应速率为
=0.6mol/(L.min),则B的反应速率为0.2mol/(L.min),故答案为:
;0.2mol/(L.min);
(2)温度升高,平衡时混合气体的平均相对摩尔质量减小,D为固体,正向移动,气体质量减小,平衡正向移动,则正反应为吸热反应,故答案为:吸热;
(3)将容器体积缩小至1升,平衡不移动,C的浓度为原来的2倍,所以C的浓度为1.2mol/L×2=2.4mol/L,温度不变,平衡常数不变,故答案为:2.4;不变.
2A(g)+B(g)?3C(g)+D(s),
开始 1 0.5 0
转化0.8 0.4 1.2
平衡0.2 0.1 1.2
(1)K=
| c3(C) |
| c2(A)c(B) |
| 1.2mol/L |
| 2min |
| c3(C) |
| c2(A)c(B) |
(2)温度升高,平衡时混合气体的平均相对摩尔质量减小,D为固体,正向移动,气体质量减小,平衡正向移动,则正反应为吸热反应,故答案为:吸热;
(3)将容器体积缩小至1升,平衡不移动,C的浓度为原来的2倍,所以C的浓度为1.2mol/L×2=2.4mol/L,温度不变,平衡常数不变,故答案为:2.4;不变.
点评:本题考查化学平衡的建立、平衡移动等,注意反应速率的关系、温度对平衡的移动即可解答,题目难度不大.

练习册系列答案
相关题目
 3C(g) +
3C(g) + D(s),2分钟反应达到平衡,此时C的浓度为1.2mol·L-1。
D(s),2分钟反应达到平衡,此时C的浓度为1.2mol·L-1。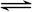 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。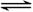 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。