题目内容
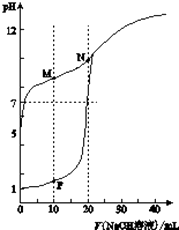
【题目】CO(g)与H2O(g)反应过程的能量变化如图所示,下列说法正确的是

A.该反应为吸热反应
B.CO(g)和H2O(g)的总能量大于CO2(g)和H2(g)的总能量
C.该反应的热化学方程式:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=+41 kJ/mol
CO2(g)+H2(g) ΔH=+41 kJ/mol
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ的热量
【答案】B
【解析】从题图数据可以看出,该反应的ΔH<0,为放热反应,CO(g)和H2O(g)的总能量大于CO2(g)和H2(g)的总能量,反应的热化学方程式为CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=41 kJ/mol。该反应的逆反应要吸收热量。
CO2(g)+H2(g) ΔH=41 kJ/mol。该反应的逆反应要吸收热量。

【题目】硒鼓回收料含硒约97%,其余为约3%的碲和微量的氯.从该回收料中回收硒的工艺流程如图所示(已知煅烧过程中,回收料中的硒、碲被氧化成SeO2和TeO2): 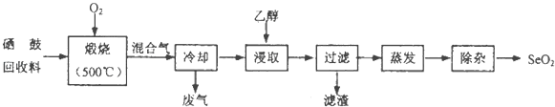
部分物质的物理性质如表:
物质 | 熔点 | 沸点 | 溶解度 |
SeO2 | 340℃(315℃升华) | 684℃ | 易溶于水和乙醇 |
TeO2 | 733℃(450℃升华) | 1260℃ | 微溶于水,不溶于乙醇 |
回答下列问题:
(1)Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为;H2Se的热稳定性比H2S的热稳定性(填“强”或“弱”).
(2)乙醇浸取后过滤所得滤渣的主要成分是 . 蒸发除去溶剂后,所得固体中仍含有少量TeO2杂质,除杂时适宜采用的方法是 .
(3)SeO2易溶于水得到H2SeO3溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式 .
(4)已知H2SeO3的电离常数K1=3.5×10﹣3、K2=5.0×10﹣8 , 回答下列问题:
①Na2SeO3溶液呈性,原因是(用离子方程式表示);
②在Na2SeO3溶液中,下列关系式正确的是:
A.c(Na+)+c(H+)=c(SeO32﹣)+c(HSeO3﹣)+c(OH﹣)
B.2c(Na+)=c(SeO32﹣)+c(HSeO3﹣)+c(H2SeO3)
C.c(Na+)=2c(SeO32﹣)+2c(HSeO3﹣)+2c(H2SeO3)
D.c(OH﹣)=c(H+)+c(HSeO3﹣)+c(H2SeO3)