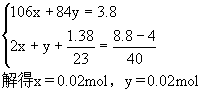题目内容
取钠、钙各一小块,投入适量水中,反应完毕时共收集氢气1.568L(标准状况)。再取碳酸钠和碳酸氢钠的混合粉末3.8g,溶于适量水中。将以上所得的两种溶液合并,恰好使溶液中
答案:
解析:
解析:
| 依题意,得到的8.8g白色固体为碳酸钙和氢氧化钠混合物,4g固体只为碳酸钙,其物质的量为: 设碳酸钠的物质的量为x,碳酸氢钠的物质的量为y 依据钠元素守恒,金属钠、碳酸钠与碳酸氢钠中钠原子的总物质的量等于8.8g固体中氢氧化钠的物质的量,可以列方程组: 所以碳酸钠的质量:0.02×106=2.12g,碳酸氢钠的质量:0.02×84=1.68g
|

练习册系列答案
相关题目