题目内容
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-99kJ?mol-1
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-99kJ?mol-1请回答下列问题:
(1)该反应属于
放热
放热
反应(填“放热”或“吸热”).(2)图中C表示
生成物的总能量
生成物的总能量
.(3)从化学键的角度分析,F代表什么意义?F
形成新键释放的能量
形成新键释放的能量
;(4)改变反应条件可改变E值大小,如加入V2O5作催化剂,可使E值减小.E的大小对该反应的反应热有
无影响
无影响
.(无影响、有影响、不确定)(5)图中△H=
-198
-198
kJ?mol-1.(6)若已知1mol SO2(g)氧化为1mol SO3(l)的△H2=-Q kJ?mol-1,则△H1
>
>
△H2(填“>”、“<”或“=”).分析:(1)根据图象中能量变化分析;
(2)A、C分别表示反应物总能量的生成物总能量;
(3)从化学键的角度分析,F代表的是形成新键放出的能量;
(4)加入V2O5作催化剂,可使E值减小,反应热可表示为A、C活化能的大小之差,活化能的大小对反应热无影响;
(5)根据参加反应SO2的物质的量之比等于对应的△H之比;
(6)根据物质状态变化时能量变化分析.
(2)A、C分别表示反应物总能量的生成物总能量;
(3)从化学键的角度分析,F代表的是形成新键放出的能量;
(4)加入V2O5作催化剂,可使E值减小,反应热可表示为A、C活化能的大小之差,活化能的大小对反应热无影响;
(5)根据参加反应SO2的物质的量之比等于对应的△H之比;
(6)根据物质状态变化时能量变化分析.
解答:解:(1)由图象中能量变化可知,反应后能量降低,所以是放热反应,
故答案为:放热;
(2)因图中A、C分别表示反应物总能量、生成物总能量,
故答案为:生成物的总能量;
(3)从化学键的角度分析,F代表的是形成新键放出的能量,
故答案为:形成新键释放的能量;
(4)加入V2O5作催化剂,可使E值减小,反应热可表示为A、C活化能的大小之差,活化能的大小对反应热无影响,
故答案为:无影响;
(5)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ?mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ?mol-1,
故答案为:-198;
(6)已知1mol SO2(g)氧化为1mol SO3(l)的△H2=-Q kJ?mol-1,SO3从气态变为液态要放热,△H2反应时放热要多,但是△H是负值,所以△H1>△H2,
故答案为:>.
故答案为:放热;
(2)因图中A、C分别表示反应物总能量、生成物总能量,
故答案为:生成物的总能量;
(3)从化学键的角度分析,F代表的是形成新键放出的能量,
故答案为:形成新键释放的能量;
(4)加入V2O5作催化剂,可使E值减小,反应热可表示为A、C活化能的大小之差,活化能的大小对反应热无影响,
故答案为:无影响;
(5)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ?mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ?mol-1,
故答案为:-198;
(6)已知1mol SO2(g)氧化为1mol SO3(l)的△H2=-Q kJ?mol-1,SO3从气态变为液态要放热,△H2反应时放热要多,但是△H是负值,所以△H1>△H2,
故答案为:>.
点评:本题考查反应过程的能量变化图以及运用盖斯定律进行反应热的计算,难度不大,注意活化能与反应热的关系.

练习册系列答案
相关题目
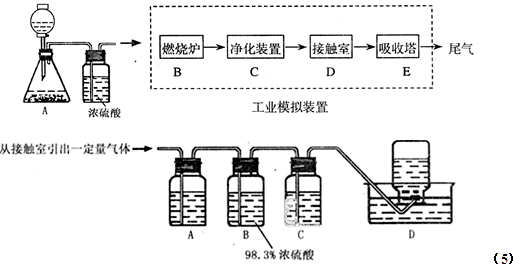
 (2009?丹东模拟)请根据工业制硫酸的有关知识回答下列问题:
(2009?丹东模拟)请根据工业制硫酸的有关知识回答下列问题: