题目内容
【题目】J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表。J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
J | ||||
R |
(1)M的离子结构示意图为__________;元素T在周期表中位于第________族。
(2)J和氢组成的化合物分子有6个原子,其分子式为______________。
(3)M和T形成的化合物在潮湿的空气中冒白烟,反应的化学方程式为___________。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为__________________________________________________________。
②L的另一种氢化物乙通常用作火箭的燃料,其组成原子数之比为1∶2,则乙的化学式为_____。
【答案】![]() ⅦA C2H4 AlCl3+3H2O===Al(OH)3+3HCl↑ 2NH3·H2O+3H2O2===N2↑+8H2O(或2NH3+3H2O2===N2↑+6H2O) N2H4
ⅦA C2H4 AlCl3+3H2O===Al(OH)3+3HCl↑ 2NH3·H2O+3H2O2===N2↑+8H2O(或2NH3+3H2O2===N2↑+6H2O) N2H4
【解析】
J元素最低负化合价的绝对值与其原子最外层电子数相等,说明J的最低化合价与最高化合价绝对值相等,则J最外层电子数为4,根据J、R都为短周期元素可以知道J为C元素,则R应为S元素,M是地壳中含量最多的金属元素,故M为Al元素,而T是原子序数最大的元素,且为短周期主族元素,故T为Cl元素,由(4)题中L的最简单气态氢化物甲的水溶液显碱性,说明L为N元素。据此解答。
根据以上分析可知J、L、M、R、T分别是C、N、Al、S、Cl。则
(1)M的离子为Al3+,结构示意图为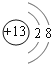 ;T为Cl元素,在周期表中位于第ⅦA族;
;T为Cl元素,在周期表中位于第ⅦA族;
(2)J和氢组成的化合物分子有6个原子,该化合物为C2H4;
(3)M和T形成的化台物为AlCl3,易水解,水解生成的HCl易结合空气中的水蒸气而形成酸雾,反应的化学方程式为AlCl3+3H2O=Al(OH)3+3HCl↑;
(4)①甲的水溶液为氨水,与H2O2反应生成的产物不污染环境,则生成N2和H2O,反应的化学方程式为2NH3·H2O+3H2O2=N2↑+8H2O;
②L的另一种氢化物乙通常用作火箭的燃料,其组成原子数之比为1∶2,则乙的化学式为N2H4。