题目内容
4.X、Y、Z三种元素原子的核电荷数在11-17之间.它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4.则下列判断不正确的是( )| A. | 最高正价:X>Y>Z | B. | 酸性:H3ZO4>H2YO4>HXO4 | ||
| C. | 稳定性:HX>H2Y>ZH3 | D. | 非金属性:X>Y>Z |
分析 X、Y、Z三种元素原子的核电荷数在11-17之间.它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4.则三种元素分别是Cl、S、P,
A.同一周期中,原子序数越大,化合价越高;
B.非金属性越强,最高价含氧酸的酸性越强;
C.非金属性越强,简单氢化物的稳定性越强;
D.同一周期中,原子序数越大,非金属性越强.
解答 解:X、Y、Z三种元素原子的核电荷数在11-17之间.它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4.则三种元素分别是Cl、S、P,
A.元素原子的最外层电子数越多,元素的最高化合价就越高,所以元素的最高正价:X>Y>Z,故A正确;
B.元素的非金属性X>Y>Z,元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,所以酸性H3ZO4<H2YO4<HXO4,故B错误;
C.元素的非金属性X>Y>Z,元素的非金属性越强,其简单氢化物的稳定性就越强.所以氢化物的稳定性:HX>H2Y>ZH3,故C正确;
D.同一周期的元素,原子序数越大,元素的非金属性就越强,所以元素的非金属性:X>Y>Z,故D正确;
故选B.
点评 本题考查元素周期表、元素周期律的应用的知识,题目难度不大,明确元素周期律内容为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
15.下列叙述不正确的是( )
| A. | CuO与H2的反应在表面皿上进行 | |
| B. | 蒸发NaC1溶液得到NaCl晶体用蒸发皿 | |
| C. | 加热CuSO4•5H2O获得CuSO4用坩埚 | |
| D. | 盐酸与金属Mg的反应可在试管中进行 |
12.下列不是碳的同素异形体的是( )
| A. | 金刚石 | B. | 石墨 | C. | CO | D. | C60 |
16.下列说法正确的是( )
| A. | 还原性:K>Na>Mg | B. | 氢化物的稳定性:H2O<H2S<H2Se | ||
| C. | 酸性:H3PO4<H2SO4<HCl | D. | 原子半径:Na<Mg<Al |
15.下列各溶液中的离子,因氧化还原反应而不能大量共存的是( )
| A. | Na+、HCO3-、K+、OH- | B. | Fe2+、H+、SO42-、NO3- | ||
| C. | Fe3+、SCN-、NH4+、Cl- | D. | AlO2-、OH-、Na+、NH4+ |
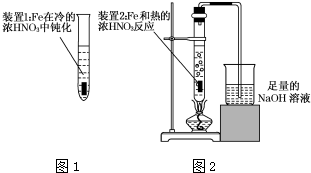 Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:
Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题: