题目内容
现有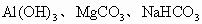 的混合物16.2g,加入过量稀硫酸溶液生成标准状况下的气体2.24L.继续向反应后的溶液中加入过量KOH溶液,生成2.9g白色沉淀.求混合物中三种物质的质量分数.
的混合物16.2g,加入过量稀硫酸溶液生成标准状况下的气体2.24L.继续向反应后的溶液中加入过量KOH溶液,生成2.9g白色沉淀.求混合物中三种物质的质量分数.
答案:
解析:
解析:
|
解:设 |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
现有Si和Al2O3的固体混合物样品,加入NaOH溶液使混合物完全溶解,所得溶液中c(Na+):c(AlO2-):c(OH-)=6:2:1,则原固体混合物中硅元素与氧元素的质量比为( )
| A、3:2 | B、3:1 | C、7:8 | D、7:16 |
|
现有乙二醇(C2H6O2)、乙二醛(C2H2O2)、醋酸(CH3COOH)组成的混合物,测得其中氢元素的质量分数为9%,则混合物中氧元素的质量分数为 | |
| [ ] | |
A. |
16% |
B. |
37% |
C. |
52% |
D. |
无法确定 |
金属元素及其化合物在科学研究和生产生活中有着广泛的用途。
(1)现有一种铜粉与氧化铜粉末的混合物。经测定,该混合物中铜元素与氧元素的质量之比为5:1。该混合物中铜与氧化铜的物质的量之比为 。
(2)取铝合金(含铝90%)1.5 g 与80 mL 3mol•L-1 盐酸充分反应(合金中其它成分不参加反应)。滤去不溶物,将滤液稀释到100mL,取出稀释液5mL,加入0.6 mol•L-1 的氨水使Al3+ 恰好完全沉淀。
上述铝合金和盐酸反应的过程中生成氢气_________L(标准状况)。使Al3+ 恰好完全沉淀时,消耗氨水_________mL。
(3)将1.84g金属钠投入98.16 g水中,向反应后的溶液里通入一定量的CO2(g),将溶液小心蒸干。计算可得固体质量的最大值。
(4)向a mL 0.8mol•L-1 NaOH(aq) 中通入b mol CO2(g),反应所得混合液的成份随b的物质的量的不同而不同。请通过计算完成下表:(溶质的质量用含a、b的代数式表示)
|
b的取值范围(mol) |
溶质的成份 |
溶质的质量(g) |
|
b<4a×10- 4 |
|
|
|
|
Na2CO3、NaHCO3 |
|
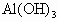 为x mol,
为x mol,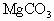 为y mol,
为y mol, 为z mol
为z mol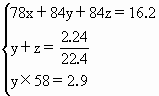
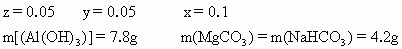
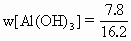 ×100%=48.2%
×100%=48.2%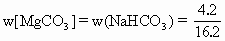 ×100%=25.9%
×100%=25.9%