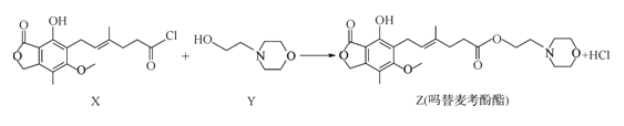
题目内容
【题目】下面是元素周期表的一部分,参照元素①﹣⑧在表中的位置,请用化学用语回答下列问题:

(1)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)____________________.
(2)在①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物,写出其中一种化合物的电子式: ______________________
(3)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:______________
(4)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为________________.
(5)常温下,由①②④组成最简单的液态有机物可作为燃料电池的原料之一,请写出其在碱性介质中的电极反应式:_________________________________
【答案】HClO4>H2CO3>H2SiO3 ![]() 2Mg+CO2
2Mg+CO2![]() 2MgO+C Si+2OH-+H2O=SiO32-+2H2↑ CH3OH+8OH﹣﹣6e﹣=CO32﹣+4H2O
2MgO+C Si+2OH-+H2O=SiO32-+2H2↑ CH3OH+8OH﹣﹣6e﹣=CO32﹣+4H2O
【解析】
根据元素周期表短周期元素的结构和性质分析解答;根据元素周期律的应用分析解答;根据燃料电池的原理分析解答。
从元素周期表中可知:①H②C③N④O⑤Na⑥Al⑦Si⑧Cl
(1) ②、⑦、⑧的最高价含氧酸分别是:H2CO3、H2SiO3、HClO4,酸性由强到弱的顺序是HClO4>H2CO3>H2SiO3;
(2) ①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物可以是NaOH,也可以是Na2O2,电子式为:![]()
![]() ;
;
(3) ⑤的同周期相邻主族元素的单质是Mg,②和④组成的化合物是CO2,发生的化学反应方程式为:2Mg+CO2![]() 2MgO+C;
2MgO+C;
(4) ⑦单质是Si,⑤的最高价氧化物的水化物是NaOH,他们发生复分解反应为:Si+2NaOH+H2O=Na2SiO3+2H2↑,离子反应方程式为:Si+2OH-+H2O=SiO32-+2H2↑;
(5) ①②④分别是H、C、O,形成最简单液态有机物可作为燃料电池的原料之一,该有机物为:CH3OH,它在碱性条件下,作负极反应物,失去电子,故电极方程式为:CH3OH+8OH﹣﹣6e﹣=CO32﹣+4H2O。