题目内容
【题目】在室温下,下列四种溶液:①0.1 mol/L NH4Cl溶液,②0.1 mol/L CH3COONH4溶液,③0.1 mol/L NH4HSO4溶液,④0.1 mol/L 氨水。请根据要求填写下列空白:
(1)溶液①呈______性(填“酸”、“碱”或“中”),其原因是___________(用离子方程式表示)。
(2)室温下,测得溶液②的pH=7,则CH3COO-与NH4+浓度的大小关系是c(CH3COO-) ________c(NH4+)(填“>”、“<”或“=”)。
(3)常温下,0.1 mol/ L CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是____________(填字母)。
A.c(H+) B. C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.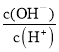 E.
E.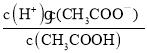
(4)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为____________。
【答案】酸 NH4+ + H2O![]() NH3·H2O + H+ = BD 10 : 1
NH3·H2O + H+ = BD 10 : 1
【解析】
(1)NH4Cl是强酸弱碱盐;
(2)根据电荷守恒,CH3COONH4溶液中c(CH3COO-) + c(OH-) =c(NH4+)+ c(H+);
(3)常温下,0.1 mol/ L CH3COOH溶液加水稀释过程中,醋酸的电离平衡正向移动,电离程度增大,电离平衡常数不变。
(4)根据c(OH-)×V(碱)=c(H+)×V(酸)计算。
(1)NH4Cl是强酸弱碱盐,NH4+发生水解反应NH4+ + H2O![]() NH3·H2O + H+,所以溶液呈酸性;
NH3·H2O + H+,所以溶液呈酸性;
(2)根据电荷守恒,CH3COONH4溶液中c(CH3COO-) + c(OH-) =c(NH4+)+ c(H+),溶液呈中性c(OH-) = c(H+),所以c(CH3COO-)=c(NH4+);
(3)A.醋酸加水稀释c(H+)减小; B.醋酸加水稀释,电离平衡正向移动, n(H+)增大、n(CH3COOH)减小,所以 增大 ; C.加水稀释,温度不变,水的离子积常数不变,所以c(H+)·c(OH-)不变; D.温度不变,水的离子积常数不变,加水稀释,醋酸加水稀释c(H+)减小,所以c(OH-)增大,
增大 ; C.加水稀释,温度不变,水的离子积常数不变,所以c(H+)·c(OH-)不变; D.温度不变,水的离子积常数不变,加水稀释,醋酸加水稀释c(H+)减小,所以c(OH-)增大, 增大; E.温度不变,加水稀释,电离平衡常数不变,所以
增大; E.温度不变,加水稀释,电离平衡常数不变,所以 不变。故选BD;
不变。故选BD;
(4)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则c(OH-)×V(碱)=c(H+)×V(酸),
![]() ,
,![]() =
=![]() 。
。