题目内容
(9分)(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1) 2NH3(g) +
2NH3(g) +  O2(g) ;△H =" a" kJ·mol—1
O2(g) ;△H =" a" kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
②已知:N2(g) + 3H2(g)
 2NH3(g) ΔH= -92.4kJ·mol—1
2NH3(g) ΔH= -92.4kJ·mol—12H2(g) + O2(g)
 2H2O(l) ΔH = -571.6kJ·mol—1
2H2O(l) ΔH = -571.6kJ·mol—1则常温下氮气与水反应生成氨气与氧气的热化学方程式为:
(2)①已知:0.5mol液态肼(N2H4)与足量的液态双氧水反应生成氮气和水蒸气,放出256kJ的热量,写出该反应的热化学方程式
②又已知H2O(g)=H2O(l) △H=-44kJ?mol-1。则32g液态肼与足量的液态双氧水反应生成氮气和液态水时放出的热量是 kJ
③此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大优点是
(1)①>、> (各1分)
②2N2(g) + 6H2O(1) = 4NH3(g) + 3O2(g) ΔH="+1530" kJ·mol-1 (2分)
或者N2(g) + 3H2O(1) = 2NH3(g) +  O2(g) ΔH="+765" kJ·mol-1 (2分)
O2(g) ΔH="+765" kJ·mol-1 (2分)
(2)①N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H="-512kJ." mol-1(2分)
②688(2分)③产物无污染(1分)
解析

(14分)I.科学家一直致力于“人工固氮”的新方法研究。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g) ΔH=a kJ·mol-1
4NH3 (g)+3O2 (g) ΔH=a kJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
 ”“<”或“=”)
”“<”或“=”)②已知:
N2 (g) + 3H2(g)
 2NH3 (g) ΔH=-92.4kJ·mol-1,
2NH3 (g) ΔH=-92.4kJ·mol-1,2H2 (g) + O2 (g)===2H2O (l) ΔH=-571.6kJ·mol-1,
则2N2 (g) + 6H2O(l)
 4NH3 (g) + 3O2 (g) ΔH= ;
4NH3 (g) + 3O2 (g) ΔH= ;(2)用水稀释0.1 mol·L-1氨水,溶液中随着水量的增加而减小的是 (填字母标号)
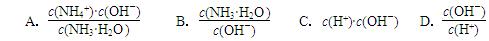
II.工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等。
(1)硫酸生产中,SO2催化氧化成SO3的热化学方程式为:
2SO2 (g) + O2(g)
 2SO3 (g) ΔH=-196.0kJ·mol-1
2SO3 (g) ΔH=-196.0kJ·mol-1①容器体积不变时,为了提高SO2的转化率,可采用的措施是 (填字母标号)
| A.加入V2O5作催化剂 | B.使用过量SO2 | C.高温 | D.通入过量空气 |
(2)已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L 含CaSO4固体的溶液中加入2.22 gCaCl2 粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将 (填“增大”、“减小”或“不变”,下同),Ksp(CaSO4)将 。
(9分)(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1)  2NH3(g) +
2NH3(g) + 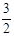 O2(g)
;△H = a kJ·mol—1
O2(g)
;△H = a kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a 0;ΔS 0,(填“>”、“<”或“=”)
②已知:N2(g) + 3H2(g) 2NH3(g) ΔH= -92.4kJ·mol—1
2NH3(g) ΔH= -92.4kJ·mol—1
2H2(g) + O2(g) 2H2O(l)
ΔH = -571.6kJ·mol—1
2H2O(l)
ΔH = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:
(2)①已知:0.5mol液态肼(N2H4)与足量的液态双氧水反应生成氮气和水蒸气,放出256kJ的热量,写出该反应的热化学方程式
②又已知H2O(g)=H2O(l) △H=-44kJ•mol-1。则32g液态肼与足量的液态双氧水反应生成氮气和液态水时放出的热量是 kJ
③此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大优点是