题目内容
6.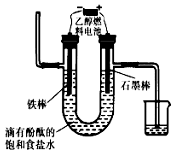 (1)在298K时,1molCH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0kJ.写出该反应的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol.现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18克液态水,并放出515kJ热量,则CH4和CO的物质的量分别为0.5mol、0.25mol.
(1)在298K时,1molCH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0kJ.写出该反应的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol.现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18克液态水,并放出515kJ热量,则CH4和CO的物质的量分别为0.5mol、0.25mol.(2)碱性乙醇燃料电池易储存,易推广,对环境污染小,具有非常广阔的发展前景.该燃料电池中,使用铂作电极,KOH溶液做电解质溶液.请写出该燃料电池负极上的电极反应式为C2H6O+16OH--12e-=2CO32-+11H2O.
(3)用乙醇燃料电池电解400mL 饱和食盐水装置可简单表示如图:该装置中发生电解反应的方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH;当阴极产生448mL气体(体积在标准状况下测得)时,停止电解,将电解后的溶液混合均匀,溶液的pH为13.(不考虑气体的溶解及溶液体积的变化)
分析 (1)依据热化学方程式书写方法解答,标注物质聚集状态和反应焓变;根据H元素守恒计算CH4的物质的量,进而计算CO的物质的量;
(2)原电池的负极发生氧化反应,乙醇燃料电池中,乙醇被氧化,所以负极为乙醇在碱性溶液中失去电子生成碳酸根离子;
(3)根据两个电极与电源的连接方式判断电解池的阴阳极,写出电解饱和食盐水的方程式;然后根据电解饱和食盐水中两极的反应判断反应现象,计算出生成氢氧化钠的物质的量,最后计算出溶液的pH.
解答 解:(1)在298K时,1mol CH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0kJ,则该反应的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol,
18克液态水的物质的量=$\frac{18g}{18g/mol}$=1mol,根据H原子守恒可知n(CH4)=$\frac{1mol×2}{4}$=0.5mol,故n(CO)=0.75mol-0.5mol=0.25mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol;0.5;0.25;
(2)在乙醇燃料电池中,负极上是燃料乙醇发生失电子的氧化反应,在碱性环境下的电极反应为:C2H6O+16OH--12e-=2CO32-+11H2O,
故答案为:C2H6O+16OH--12e-=2CO32-+11H2O;
(3)根据图示可知,左侧的电极连接电源的负极,为电解池的阴极,所以左侧发生还原反应生成氢气;右侧连接原电池的直接,所以电解池的右侧为阳极,阳极发生氧化反应生成氯气,电极饱和食盐水的方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH;阴极生成标况下的448mL气体,该气体为氢气,标况下448mL氢气的物质的量为0.02mol,根据反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH可知,生成0.02mol氢气会生成0.04mol氢氧化钠,则该溶液中氢氧根离子浓度为:c(OH-)=c(NaOH)=$\frac{0.04mol}{0.4L}$=0.1mol/L,溶液中氢离子浓度为:1×10-13mol/L,溶液的pH=13,
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH;13.
点评 本题考查了热化学方程式的书写、原电池工作原理及电极反应式的书写,题目难度中等,注意掌握热化学方程式的书写原则,能够根据盖斯定律及已知热化学方程式写出新的热化学方程式;明确原电池、电解池工作原理,能够正确书写电极反应式.

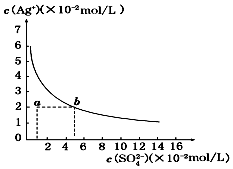
| A. | 含有大量SO42-的溶液中肯定不存在Ag+ | |
| B. | 0.02 mol/L的AgNO3溶液与0.2 mol/L的Na2SO4溶液等体积混合不会生成沉淀 | |
| C. | Ag2SO4的溶度积常数(Ksp)为1×10-3 | |
| D. | a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
| 选项 | 环境要求 | 离子组 |
| A | Fe2(SO4)3溶液中 | K+、AlO2-、Cl-、NO3- |
| B | 与Al反应能放出H2的溶液中 | Fe2+、Na+、NO3-、SO42- |
| C | 水电离产生的c(H+)=10-12mol/L的溶液 | ClO-、CO32-、NH4+、NO3-、SO32- |
| D | 向溶液中逐滴滴加烧碱溶液先有沉淀产生,后沉淀消失 | Na+、Al3+、Cl-、SO42- |
| A. | A | B. | B | C. | C | D. | D |
| A. | v (C)=3 mol/(L•min) | B. | v (D)=0.5 mol/(L•s) | ||
| C. | v (B)=0.6 mol/(L•s) | D. | v (A)=12 mol/(L•min) |
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 漂白粉 | 硫酸 | 醋酸 | 干冰 |
| B | 氢氧化钡 | 蔗糖溶液 | 硫酸钡 | 溴水 | 二氧化硫 |
| C | 胆矾 | 石灰水 | 氧化铝 | 水 | 氯气 |
| D | 小苏打 | 氢氧化铁胶体 | 氯化银 | 次氯酸 | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Cl2通入NaOH溶液:Cl2+OH-=Cl-+ClO-+H2O | |
| B. | NaHCO3溶液中加入稀HCl:CO32-+2H+=CO2↑+H2O | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O=[Al(OH)4]-+4NH4+ | |
| D. | Cu溶于稀HNO3:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
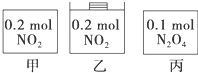 甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的( )
甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的( )| A. | 平衡时各容器内n(NO2)的大小顺序为乙>甲>丙 | |
| B. | 平衡时NO2的百分含量:乙>甲=丙 | |
| C. | 平衡时甲中NO2与丙中N2O4的转化率一定相同 | |
| D. | 平衡时混合物的平均相对分子质量:乙>甲=丙 |
 A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去):
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去):