题目内容
17.碘酸钾作为食盐-碘添加剂,而碘化钾则是化工生产中一种重要原料.还原法生产碘化钾是由碘与氢氧化钾反应生成碘酸钾后,用甲酸还原而得,其主要流程如图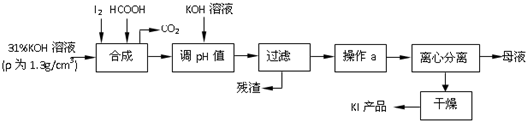
请回答下列问题:
(1)判断“合成”过程中,碘是否已完全反应的方法是取少量反应后的混合液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已完全反应,反之则未完全反应.
(2)实验室中,过滤操作要求“一贴二低三靠”,其中“三靠”是指盛有被过滤液体的烧杯注液口紧靠玻璃棒、玻璃棒下端紧靠三层滤纸处、漏斗下端尖口紧靠烧杯内壁.操作a 包括“蒸发浓缩、冷却结晶”是依据KI具有何种性质:碘化钾在水中的溶解度随温度的影响较大.
(3).写出“合成”过程中,HCOOH参与的离子反应方程式:3HCOOH+IO3-=I-+3H2O+3CO2↑.
(4).测定产品中KI含量的方法是:
a.称取3.340g样品、溶解,在250mL容量瓶中定容;
b.量取25.00mL溶液于锥形瓶中,加入足量KIO3,用少量稀硫酸酸化所,使KIO3与KI反应完全;
c.以淀粉为指示剂,用0.2400mol/L的Na2S2O3溶液滴定,消耗溶液体积平均值为10.00mL.
已知:IO3-+I-+H+=I2+H2O(未配平),I2+2S2O32-=2I-+S4O62-.
①测定过程所需仪器在使用前必须检查是否漏液的有250mL容量瓶、滴定管.
②该样品中KI的质量分数为99.4%.(保留3位有效数字)
分析 由碘与氢氧化钾反应生成碘酸钾后,用甲酸还原碘酸钾生成KI和二氧化碳气体,调节溶液pH过滤除去杂质,溶液经蒸发浓缩、冷却结晶、分离、干燥可得到碘化钾,
(1)可用淀粉检验碘是否完全反应;
(2)过滤时,盛有被过滤液体的烧杯注液口紧靠玻璃棒、玻璃棒下端紧靠三层滤纸处、漏斗下端尖口紧靠烧杯内壁;操作a 包括“蒸发浓缩、冷却结晶”,说明KI的
溶解度随温度的影响较大;
(3)由题意可知甲酸还原碘酸钾生成KI和二氧化碳气体,同时生成水;
(4)①测定产品中KI含量使用容量瓶和滴定管,使用前必须检查是否漏水;
②KIO3与KI反应完全的化学方程式为IO3-+5I-+6H+=3I2+3H2O,反应的关系式为5I-~3I2~6S2O32-,结合关系式法计算.
解答 解:由碘与氢氧化钾反应生成碘酸钾后,用甲酸还原碘酸钾生成KI和二氧化碳气体,调节溶液pH过滤除去杂质,溶液经蒸发浓缩、冷却结晶、分离、干燥可得到碘化钾,
(1)可用淀粉检验碘是否完全反应,操作方法为取少量反应后的混合液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已完全反应;反之,则未完全反应,
故答案为:取少量反应后的混合液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已完全反应,反之则未完全反应;
(2)过滤时,盛有被过滤液体的烧杯注液口紧靠玻璃棒、玻璃棒下端紧靠三层滤纸处、漏斗下端尖口紧靠烧杯内壁;操作a 包括“蒸发浓缩、冷却结晶”,说明KI的
溶解度随温度的影响较大,
故答案为:玻璃棒下端紧靠三层滤纸处;碘化钾在水中的溶解度随温度的影响较大;
(3)甲酸还原碘酸钾生成KI和二氧化碳气体,同时生成水,反应的离子方程式为3HCOOH+IO3-=I-+3H2O+3CO2↑,
故答案为:3HCOOH+IO3-=I-+3H2O+3CO2↑;
(4)①测定产品中KI含量使用容量瓶和滴定管,使用前必须检查是否漏水,
故答案为:250mL容量瓶、滴定管;
②KIO3与KI反应完全的化学方程式为IO3-+5I-+6H+=3I2+3H2O,
反应的关系式为5I-~3I2~6S2O32-,n(Na2S2O3)=0.2400mol/L×0.01L=2.4×10-3mol,
由关系式可知n(KI)=2.4×10-3mol×$\frac{5}{6}$=2×10-3mol,
则3.340g样品中含有KI的质量为2×10-3mol×$\frac{250}{25}$×166g/mol=3.32g,
则样品中KI的质量分数为$\frac{3.32}{3.34}$×100%=99.4%,
故答案为:99.4%.
点评 本题考查较为综合,涉及物质的分离、提纯以及含量的测定等知识,为高考常见题型,侧重于学生的分析、实验和计算能力的考查,题目难度中等,本题注意从质量守恒的角度利用关系式法计算纯度.

| N2(mol•L-1) | H2(mol•L-1) | NH3(mol•L-1) | |
| 起始时 | 3 | 3 | 0 |
| 2s末 | 2.6 | 1.8 | 0.8 |
(1)用H2表示该反应2s内的平均反应速率为0.6 mol•L-1•s-1.
(2)不能(填“能”或“不能”)确认该反应2s末已达化学平衡状态.
| A. | H2SO4的酸性比HClO的酸性强,所以S的非金属性比Cl强 | |
| B. | Mg(OH)2是中强碱,Al(OH)3是两性氢氧化物,所以Al比Mg活泼 | |
| C. | H2S 300℃时开始分解,H2O 1000℃时开始分解,说明O的非金属性比S强 | |
| D. | Na和Mg与酸都能激烈反应放出氢气,故无法比较它们的金属性强弱 |
| A. | 它们都有酸性,电离出的H+有弱氧化性 | |
| B. | 它们都是酸,彼此之间不发生反应 | |
| C. | 亚硫酸易分解放出SO2,所以它是挥发性酸 | |
| D. | 在空气中放置,它们都会因氧化而变质 |
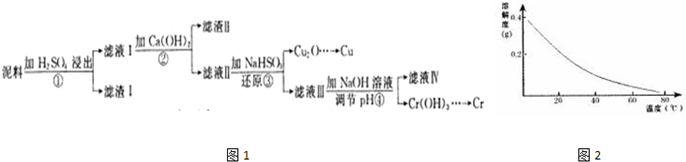 已知:部分物质沉淀的pH如表:
已知:部分物质沉淀的pH如表:| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(1)滤液I中所含溶质主要有Fe2(SO4)3、Cr2(SO4)3、CuSO4(填化学式).
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为3.2<pH≤4.3,然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为Fe(OH)3、CaSO4.
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体.写出该步骤中发生反应的离子方程式2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+、HSO3-+H+=SO2↑+H2O.
(4)当离子浓度≤1×10-5mol•L-1时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值经计算为5.6.则得出该值时还必须提供的数据是:溶度积常数.
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式:Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr.
 白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列1mol化学键需要吸收的能量分别为:P-P a kJ、P-O b kJ、P=O c kJ、O=O d kJ.根据下图所示的分子结构和有关数据估算1mol P4发生该反应放出的热量是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列1mol化学键需要吸收的能量分别为:P-P a kJ、P-O b kJ、P=O c kJ、O=O d kJ.根据下图所示的分子结构和有关数据估算1mol P4发生该反应放出的热量是( )| A. | (6a+5d-4c-12b) kJ | B. | (4c+12b-6a-5d) kJ | C. | (4c+12b-4a-5d) kJ | D. | (5a+5d-4c-12b) kJ |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 蘸有浓氨水的玻璃棒靠近某溶液 | 有白烟产生 | 该溶液可能是浓盐酸 |
| B | 将SO2通入Ba(NO3)2溶液 | 产生白色沉淀 | SO2与可溶性钡盐均可生成白色沉淀 |
| C | 将湿润淀粉碘化钾试纸检验某溶液 | 试纸变蓝 | 该溶液一定是氯水 |
| D | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内中子数多于质子数 |

| A. | 甲装置:用所示装置分离出溴苯 | |
| B. | 乙装置:加热浓硫酸和乙醇混合液,制取乙烯 | |
| C. | 丙装置:加热苯和硝基苯的混合物,分离出苯 | |
| D. | 丁装置:验证溴乙烷发生消去反应生成烯烃 |