题目内容
在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mol SO2使之反应生成SO3气体:2SO2+
O2 2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
(1)2min内,平均反应速率v(SO3)=
(2)2min时,SO2的浓度为
【答案】
(1)0.2mol/(L·min) (2)1.1mol/L
【解析】
试题分析:2 min时,测得O2的物质的量为1.6 mol,则参加反应的氧气是2mol-1.6mol=0.4mol
2SO2 + O2 2SO3
2SO3
起始浓度(mol/L) 1.5 1 0
转化浓度(mol/L) 0.4 0.2 0.4
2min时(mol/L) 1.1 0.8 0.4
所以(1)2min内,平均反应速率v(SO3)=0.4mol/L÷2min=0.2mol/(L·min)
2min时,SO2的浓度为1.1mol/L
考点:考查反应速率的计算
点评:在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某时刻的量,然后依据已知条件列式计算即可,有利于培养学生的规范答题能力。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
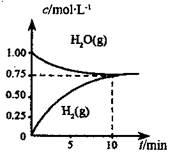
 工业上制备合成气的工艺主要是水蒸气重整甲烷:
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4 (g)+H20(g)═C0(g)+3H2(g)△H>0,在一定 条件下,向体积为1L的密闭容器中充入1mol CH4 ( g)和1mol H20(g),测得H2O(g)和H2(g)的浓度随时间变化 曲线如右图所示,下列说法正确的是( )
| A、达平衡时,CH4(g)的转化率为75% | B、O-10 min 内,v(CO)=0.075 mol?L-1.min-1 | C、该反应的化学平衡常数K=O.1875 mol?L-1 | D、当CH4(g)的消耗速率与H20(g)的生成速率相等,反应到达平衡 |
 2SO3(l),2min后测得O2的物质的量为1.6mol,则:
2SO3(l),2min后测得O2的物质的量为1.6mol,则: 工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.
工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.
 2SO3,2min时,测得O2的物质的量为1.6mol,则:
2SO3,2min时,测得O2的物质的量为1.6mol,则: