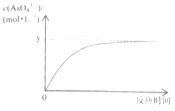
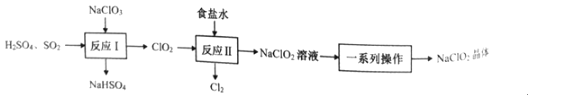
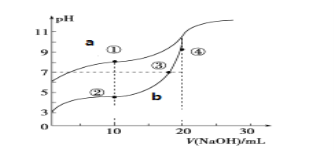
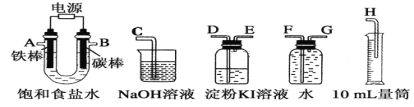
题目内容
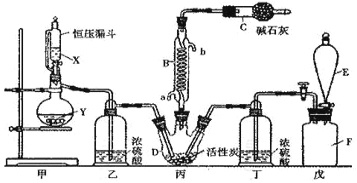
【题目】氨催化氧化法制硝酸是工业生产硝酸的主要途径,某同学利用该原理在实验室探究硝酸的制备和性质,设计了如图所示装置。
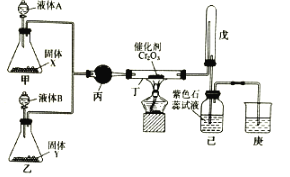
回答下列问题:
(1)甲、乙两装置分别制取氨气和氧气。盛装液体A、B的仪器名称为__。若固体X是NaOH,则液体A为__(填名称);若Y是淡黄色固体、B为纯净物,则液体B为__(填化学式);若固体Y是MnO2,则液体B为__(填化学式)。
(2)丁中发生反应的化学方程式为__。
(3)装置戊的作用是__。
(4)为防止过量的氨气影响硝酸的制备和性质实验,可在丁、戊之间添加一个U型干燥管,其中盛装的试剂可以是下列中的__。(填标号)
A.碱石灰
B.生石灰
C.浓硫酸
D.无水氯化钙
(5)改装后,实验中观察到戊装置中的气体变为红棕色,己瓶中溶液颜色变红。若通入到己瓶中的红棕色混合气体恰好与水完全反应且无其他气体生成,则己瓶中发生反应的化学方程式为___。
【答案】分液漏斗 浓氨水 H2O H2O2 4NH3+5O2![]() 4NO+6H2O 防倒吸 D 4NO2+O2+2H2O=4HNO3
4NO+6H2O 防倒吸 D 4NO2+O2+2H2O=4HNO3
【解析】
(1)常温下,浓氨水和氢氧化钠混合放出氨气;常温下,过氧化钠和水反应放出氧气;二氧化锰与过氧化氢反应放出氧气;
(2)丁中氨气和氧气发生催化氧化反应生成一氧化氮和水;
(3)根据二氧化氮易溶于水分析;
(4)根据题意,该试剂只吸收氨气、不能吸收二氧化氮,且U型干燥管只能盛放固体试剂;
(5)若通入到己瓶中的红棕色混合气体恰好与水完全反应且无其他气体生成,说明二氧化氮、氧气、水恰好反应生成硝酸;
(1)根据装置图,可知仪器A、B是分液漏斗;常温下,浓氨水和氢氧化钠混合放出氨气,则液体A为浓氨水;若Y是淡黄色固体,Y是过氧化钠,常温下,过氧化钠和水反应放出氧气,则液体B为H2O;二氧化锰与过氧化氢反应放出氧气,若固体Y是MnO2,则液体B为H2O2;
(2)丁中氨气和氧气发生催化氧化反应生成一氧化氮和水,反应的化学方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)二氧化氮易溶于水,装置戊的作用是防倒吸;
(4)A.碱石灰吸收二氧化氮不吸收氨气,不选A;
B.生石灰吸收二氧化氮不吸收氨气,不选B;
C.浓硫酸吸收氨气,是液体干燥剂,不选C;
D.无水氯化钙吸收氨气不吸收二氧化氮,故选D;
(5)若通入到己瓶中的红棕色混合气体恰好与水完全反应且无其他气体生成,说明二氧化氮、氧气、水恰好反应生成硝酸,反应方程式是4NO2+O2+2H2O=4HNO3。

【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2)⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有__________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_________。
(4
(5)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式);呈两性的氢氧化物是_________(填物质化学式),该化合物与NaOH溶液反应的离子方程式为___________。
(6)用电子式表示元素③与⑨形成化合物的过程_____________________________。