题目内容
4.8.4gCO与16gO2组成的混合气体,在标准状况下的体积为多少升?1mol这种混合气体的质量是多少克?若通过电火花引燃使原混合气(8.4gCO与16gO2)充分反应,所得气体在标准状况下的体积为多少升?(注意:要写出每步计算的公式,且带单位计算)分析 根据n=$\frac{m}{M}$计算出一氧化碳和氧气的物质的量,再根据V=nVm计算出该混合气体的体积;根据混合气体总重量及总物质的量计算出1mol该混合气体的质量;根据一氧化碳和氧气的物质的量及燃烧的方程式判断过量情况,然后利用差量法计算出反应后气体的物质的量及体积.
解答 解:8.4gCO的物质的量为:$\frac{8.4g}{28g/mol}$=0.3mol,
16g氧气的物质的量为:$\frac{16g}{32g/mol}$=0.5mol,
该混合气体的总物质的量为:0.3mol+0.5mol=0.8mol,
标准状况下0.5mol该混合气体的体积为:22.4L/mol×0.8mol=17.92L;
0.8mol该混合气体的总重量为:8.4g+16g=24.4g,
则1mol这种气体的质量为:24.4g×$\frac{1mol}{0.8mol}$=30.5g;
根据反应2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2可知,0.3molCO完全反应消耗氧气的物质的量为:0.3mol×$\frac{1}{2}$=0.15mol<0.5mol,说明氧气过量,
2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 △n(减少),
2 1 2 1
0.3mol 0.15mol,
则反应后气体总物质的量为:0.8mol-0.15mol=0.65mol,
标准状况下0.65mol气体的体积为:22.4L/mol×0.65mol=14.56L,
答:8.4gCO与16gO2组成的混合气体在标准状况下的体积为17.92L;1mol这种混合气体的质量是30.5g;若通过电火花引燃使原混合气(8.4gCO与16gO2)充分反应,所得气体在标准状况下的体积为14.53L.
点评 本题考查了混合物反应的计算,题目难度中等,明确物质的量与摩尔质量、气体摩尔体积等物理量之间的关系为解答关键,注意掌握差量法在化学计算中的应用方法.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. | 溴离子具有氧化性 | B. | 氯气是还原剂 | ||
| C. | 该反应属于复分解反应 | D. | 氯气氧化性比溴单质的强 |
| A. | 常温下向10mlPH=12的NaOH溶液中加入PH=2的HA至PH=7所得的溶液的总体积V≧20ml | |
| B. | 在做中和滴定实验时向滴有酚酞的NaOH溶液中滴加盐酸至溶液恰好无色,此时溶液PH<7 | |
| C. | 肥田粉溶于水所得溶液中C(NH4+)>C(SO42-)>C(H+)>C(OH-) | |
| D. | PH>7的草酸钾溶液中C(OH-)-C(H+)=4 C(H2C2O4)+2 C(HC2O4-)+2 C(C2O42-)-C(K+) |
| A. | 0.5mol | B. | 1mol | C. | 1.5mol | D. | 2mol |
| A. | HCl的电子式: | B. | 氯离子(Cl-)的结构示意图: | ||
| C. | 乙酸的结构简式:C2H4O2 | D. | 质子数为17、中子数为20的氯原子: |


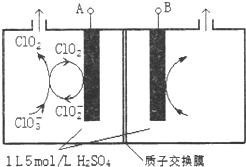 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.