题目内容
已知:Fe2O3(s)+3/2C(s)= 3/2CO2(g)+2Fe(s);△H=+234.1KJ/molC(s)+ O2(g)= CO2(g); △H= -393.5KJ/mol则4Fe(s)+ 3O2(g)=2Fe2O3(s)的△H是
- A.-1648.8KJ/mol
- B.-824.4KJ/mol
- C.+1648.8KJ/mol
- D.-744.7KJ/mol
A
考查盖斯定律的应用。将反应①Fe2O3(s)+3/2C(s)= 3/2CO2(g)+2Fe(s)和反应②C(s)+ O2(g)= CO2(g)叠加,即②×3-①×2得到4Fe(s)+ 3O2(g)= 2Fe2O3(s),所以△H=-393.5KJ/mol×3-234.1KJ/mol×2=-1648.8KJ/mol,所以答案选A。
考查盖斯定律的应用。将反应①Fe2O3(s)+3/2C(s)= 3/2CO2(g)+2Fe(s)和反应②C(s)+ O2(g)= CO2(g)叠加,即②×3-①×2得到4Fe(s)+ 3O2(g)= 2Fe2O3(s),所以△H=-393.5KJ/mol×3-234.1KJ/mol×2=-1648.8KJ/mol,所以答案选A。

练习册系列答案
 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目

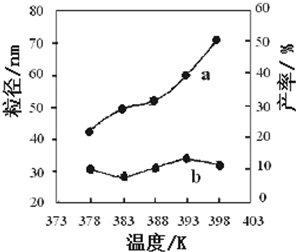 I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为: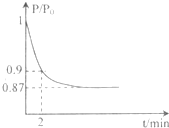 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.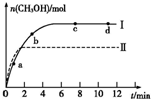 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.