题目内容
一定条件下,物质A~E转化关系如右图,其中A为单质,常温下E为无色液体.
(1)若A、C、D均含氯元素,C为氯碱工业的原料,D溶液具有漂白性,则A与B反应的化学方程式是______;D溶液可使KI淀粉溶液显蓝色,则D与KI在溶液中反应的离子方程式是______;过量B溶液与NH4HCO3溶液共热,生成气体G的离子方程式是______,G遇硝酸蒸气的现象是______.
(2)若A为红色金属,B为某酸的浓溶液,D可形成酸雨的无色气体.A与B反应的化学
是______;a molA与足量的B充分反应后,将产生的D通入NaOH溶液中,恰好完全反应,则所需NaOH的物质的量的范围是______.
(3)上述(1)、(2)中的D都能使品红溶液褪色,利用褪色后的溶液,探究使品红溶液褪色的物质的实验方法是______.
解:(1)结合转化关系,若A、C、D均含氯元素,C为氯碱工业的原料,D溶液具有漂白性,判断C为NaCl;D为NaClO,E为H2O;A为Cl2;B为NaOH;则A与B反应是氯气和氢氧化钠溶液的反应,反应的学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;D溶液是NaClO,可使KI淀粉溶液显蓝色,什么次氯酸根离子氧化碘离子为单质碘,碘遇淀粉变蓝,则D与KI在溶液中反应的离子方程式:2I-+ClO-+H2O=I2+Cl-+2OH-;过量B溶液是NaOH溶液,与NH4HCO3溶液共热,生成气体G为NH3,的离子方程式:NH4++HCO3-+2OH- CO32-+NH3↑+2 H2O;氨气遇硝酸蒸气会生成硝酸铵固体小颗粒,产生白烟.
CO32-+NH3↑+2 H2O;氨气遇硝酸蒸气会生成硝酸铵固体小颗粒,产生白烟.
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;2I-+ClO-+H2O=I2+Cl-+2OH-;NH4++HCO3-+2OH- CO32-+NH3↑+2 H2O;产生白烟.
CO32-+NH3↑+2 H2O;产生白烟.
(2)若A为红色金属,B为某酸的浓溶液,D可形成酸雨的无色气体.推断为A为Cu,B为浓硫酸;D为SO2;E为H2O;C为硫酸铜;A与B反应的化学方程式为:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;a molCu与足量的H2SO4(浓)充分反应后,生成SO2物质的量为amol,将产生的amolSO2通入NaOH溶液中,恰好完全反应,当全部生成亚硫酸钠需要氢氧化钠物质的量为2amol,若全部生成亚硫酸氢钠,需要的氢氧化钠物质的量为amol,所以所需NaOH的物质的量的范围是:a mol≤n(NaOH)≤2a mol;
CuSO4+SO2↑+2H2O;a molCu与足量的H2SO4(浓)充分反应后,生成SO2物质的量为amol,将产生的amolSO2通入NaOH溶液中,恰好完全反应,当全部生成亚硫酸钠需要氢氧化钠物质的量为2amol,若全部生成亚硫酸氢钠,需要的氢氧化钠物质的量为amol,所以所需NaOH的物质的量的范围是:a mol≤n(NaOH)≤2a mol;
故答案为:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol
CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol
(3))(1)中D为NaClO,利用次氯酸水解生成的次氯酸漂白,是强氧化性的作用,把有色物质氧化为无色物质;(2)中D为SO2;是和水反应生成的亚硫酸和有色物质结合为不稳定的无色物质,加热恢复原来的颜色;能使品红溶液褪色,利用褪色后的溶液,探究使品红溶液褪色的物质的方案为:取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色.
故答案为:取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色.
分析:(1)A为单质,常温下E为无色液体,若A、C、D均含氯元素,C为氯碱工业的原料,D溶液具有漂白性,判断C为NaCl;D为NaClO,E为H2O;A为Cl2;B为NaOH;
(2)若A为红色金属,B为某酸的浓溶液,D可形成酸雨的无色气体.推断为A为Cu,B为浓硫酸;D为SO2;E为H2O;C为硫酸铜;
(3)(1)中D为NaClO,(2)中D为SO2;结合二者漂白性的原理本题分析;
点评:本题考查了物质关系的应用物质性质的运用,驻澳考查氯气和碱反应的产物分析,性质应用,铜和浓硫酸反应产物二氧化硫的性质应用,次氯酸和二氧化硫漂白性的比较和实验方案设计.
 CO32-+NH3↑+2 H2O;氨气遇硝酸蒸气会生成硝酸铵固体小颗粒,产生白烟.
CO32-+NH3↑+2 H2O;氨气遇硝酸蒸气会生成硝酸铵固体小颗粒,产生白烟.故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;2I-+ClO-+H2O=I2+Cl-+2OH-;NH4++HCO3-+2OH-
 CO32-+NH3↑+2 H2O;产生白烟.
CO32-+NH3↑+2 H2O;产生白烟.(2)若A为红色金属,B为某酸的浓溶液,D可形成酸雨的无色气体.推断为A为Cu,B为浓硫酸;D为SO2;E为H2O;C为硫酸铜;A与B反应的化学方程式为:
Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O;a molCu与足量的H2SO4(浓)充分反应后,生成SO2物质的量为amol,将产生的amolSO2通入NaOH溶液中,恰好完全反应,当全部生成亚硫酸钠需要氢氧化钠物质的量为2amol,若全部生成亚硫酸氢钠,需要的氢氧化钠物质的量为amol,所以所需NaOH的物质的量的范围是:a mol≤n(NaOH)≤2a mol;
CuSO4+SO2↑+2H2O;a molCu与足量的H2SO4(浓)充分反应后,生成SO2物质的量为amol,将产生的amolSO2通入NaOH溶液中,恰好完全反应,当全部生成亚硫酸钠需要氢氧化钠物质的量为2amol,若全部生成亚硫酸氢钠,需要的氢氧化钠物质的量为amol,所以所需NaOH的物质的量的范围是:a mol≤n(NaOH)≤2a mol;故答案为:Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol
CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol(3))(1)中D为NaClO,利用次氯酸水解生成的次氯酸漂白,是强氧化性的作用,把有色物质氧化为无色物质;(2)中D为SO2;是和水反应生成的亚硫酸和有色物质结合为不稳定的无色物质,加热恢复原来的颜色;能使品红溶液褪色,利用褪色后的溶液,探究使品红溶液褪色的物质的方案为:取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色.
故答案为:取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色.
分析:(1)A为单质,常温下E为无色液体,若A、C、D均含氯元素,C为氯碱工业的原料,D溶液具有漂白性,判断C为NaCl;D为NaClO,E为H2O;A为Cl2;B为NaOH;
(2)若A为红色金属,B为某酸的浓溶液,D可形成酸雨的无色气体.推断为A为Cu,B为浓硫酸;D为SO2;E为H2O;C为硫酸铜;
(3)(1)中D为NaClO,(2)中D为SO2;结合二者漂白性的原理本题分析;
点评:本题考查了物质关系的应用物质性质的运用,驻澳考查氯气和碱反应的产物分析,性质应用,铜和浓硫酸反应产物二氧化硫的性质应用,次氯酸和二氧化硫漂白性的比较和实验方案设计.

练习册系列答案
相关题目

 (2010?东城区二模)一定条件下,物质A~E转化关系如右图,其中A为单质,常温下E为无色溶液体.
(2010?东城区二模)一定条件下,物质A~E转化关系如右图,其中A为单质,常温下E为无色溶液体.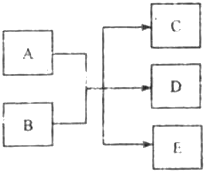 (2011?河西区一模)在一定条件下,物质A~E相互转化的关系如下图所示,其中A为单质,常温下E是无色液体.请根据条件回答下列问题(填写化学用语):
(2011?河西区一模)在一定条件下,物质A~E相互转化的关系如下图所示,其中A为单质,常温下E是无色液体.请根据条件回答下列问题(填写化学用语):

