��Ŀ����
����Ŀ�����������(KIO3)��һ�ְ�ɫ����ɫ���壬������ˮ�����н�ǿ�������ԡ���������ʳ�������Է��ε�ȱ��������֪��ij��Ӧ��ϵ�д������¼������ʣ� KIO3��K2SO4��KI��I2��H2SO4��H2O��
��1��д��������Ӧ�Ļ�ѧ����ʽ_________��
��2������˵������ȷ����_____��
A��I2�Ƿǵ���� B��K2SO4��Һ�ĵ���������KI��Һ��ǿ
C��H2SO4��Һ�ڸ÷�Ӧ������������ D��KIO3�������������л�ԭ��
��������(ClO2)�Ǹ�Ч��ȫ������ˮ���������õ�Խ��Խ�㷺��Ӧ�ã�ʵ���ҿ���KClO3ͨ�����·�Ӧ�Ƶã�2KClO3��H2C2O4��H2SO4===2ClO2����K2SO4��2CO2����2H2O���Իش��������⡣
��3���÷�Ӧ�л�ԭ����Ļ�ѧʽ��_____����������Ԫ����______��
��4���õ����ű��������Ӧ�ĵ���ת�����____2KClO3��H2C2O4��H2SO4 == 2ClO2����K2SO4��2CO2����2H2O
��5��ClO2��Cl2���ܽ���Ʒ�ˮ�е�CN ��ӦΪ�������ʣ�������Ӧ�������Cl���˹���˵��ClO2��Cl2������__ (����������������ԭ��)�ԡ���������ͬ��CN�ĵ�Ʒ�ˮ������Cl2�����ʵ�����ClO2��___����
���𰸡�KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O CD ClO2 C ![]() ���� 2.5
���� 2.5
��������
��.��1������� (KIO3) ���н�ǿ�������ԣ�����KI������I2���仯ѧ��Ӧ����ʽΪ��![]()
��2��A. ��ˮ��Һ������״̬�²��ܵ���Ļ���������ǵ���ʣ�I2�ǵ��ʣ����Ƿǵ���ʣ�A����
B. �������Һ�ĵ���������ǿ����Ҫ�������ƶ����ӵ�Ũ�ȵĴ�С����������Ũ��Խ��������Խǿ��K2SO4��Һ��KI��Һ��Ũ��δ֪�����Ƚ��䵼��������B����
C. �÷�Ӧ�е�Ԫ�صĻ��ϼ۷����˱仯��H2SO4��Һֻ�����������ԣ�C��ȷ��
D. KIO3�е�Ԫ�صĻ��ϼ�Ϊ+5���ȿ�������Ҳ���Խ��ͣ�KIO3�������������л�ԭ�ԣ�D��ȷ��
��.��3���÷�Ӧ�У�KClO3��ClԪ�صĻ��ϼ۴�+5��Ϊ+4�����ϼ۽��ͣ�����ԭ��������ԭ��Ӧ������������ClO2Ϊ��ԭ���H2C2O4��CԪ�صĻ��ϼ۴�+3��Ϊ+4�����ϼ����ߣ�������������������Ӧ������ԭ����CO2Ϊ���������������Ԫ����CԪ�ء�
��4��![]()
��5��ClO2��Cl2���ܽ�CN ��ӦΪ�������ʣ�������Ӧ�������Cl��ClԪ�صĻ��ϼ۾����ͣ�����ԭ��������ԭ��Ӧ���������������������ԣ�������ͬ����CN����Cl2��ClO2ת�Ƶĵ�����Ӧ��ͬ��1mol Cl2��2Cl�� ת��2mol e����1mol ClO2��Cl�� ת��5mol e������������ͬ��CN�ĵ�Ʒ�ˮ������Cl2�����ʵ�����ClO2��2.5����

 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д� ������ʱ����ҵ����ϵ�д�
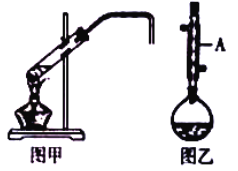
������ʱ����ҵ����ϵ�д�����Ŀ����ѧʵ��С������ʵ�����Ʊ������飨ͼ�ף���1���嶡�飨ͼ�ң����漰��ѧ��Ӧ���£�
NaBr+H2SO4�THBr+NaHSO4 ��
C2H5��OH+HBrC2H5��Br+H2O ��
CH3CH2CH2CH2��OH+HBrCH3CH2CH2CH2��Br+H2O ��
���ܴ��ڵĸ���Ӧ�У�����Ũ����Ĵ�������ˮ����ϩ���ѣ�Br����Ũ��������ΪBr2�ȡ��й������б����£�
�Ҵ� | ������ | ������ | 1���嶡�� | |
�ܶ�/gcm��3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
�е�/�� | 78.5 | 38.4 | 117.2 | 111.6 |
��ش��������⣺
��1��ͼ��������A������Ϊ_____��
��2���Ҵ��ķе����������ķе㣬��ԭ����_____��
��3����1���嶡��ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�������_____����ϲ㡱�����²㡱���ֲ㡱����
��4���Ʊ������У������Ũ����������ϡ�ͣ���Ŀ����_____��������ĸ��
A�����ٸ�����ϩ���ѵ�����
B������Br2������
C������HBr�Ļӷ�
D��ˮ�Ƿ�Ӧ�Ĵ���
��5������ȥ������е���������Br2���������������ʺϵ���_____��������ĸ��
A��NaIB��NaOHC��NaHSO3D��KCl
��6���Ʊ������飨ͼ�ף�ʱ�����ñ߷�Ӧ����������ķ�������������_____�����Ʊ�1���嶡�飨ͼ�ң�ʱȴ���ܱ߷�Ӧ�����������ԭ����_____��
����Ŀ��ij�о���ѧϰС�����þ�ڶ�����̼�е�ȼ�շ�Ӧ����Ϊ�ƺͶ�����̼Ҳ���Է�����Ӧ�����Ƕ�����CO2������ȼ�ս���������ʵ�飺
��1��������ͼװ���Ʊ�CO2������װ���з�Ӧ�����ӷ���ʽΪ_________��
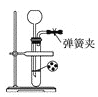
��2�����Ƶõ�CO2�������������a�ڻ���ͨ����ͼװ�ã���װ���еĿ����ž����ȼ�ƾ��ƣ��۲쵽����ֱ���е���ȼ�գ�����Ϊ��ɫ������ȴ�ܱڸ��к�ɫ�����Ͱ�ɫ���ʡ�
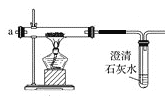
����˵��װ���п����Ѿ��ž���������_________��
����δ�ž������Ϳ�ʼ���ȣ�����ܷ����Ļ�ѧ��Ӧ����ʽ��ҪΪ_________��
��3�������Ż𣬿���ѡ�õ����������_________��
A��ˮ B����ĭ���� C����ɳ�� D��������̼
��4����С��ͬѧ�Թܱڵİ�ɫ���ʵijɷֽ������۲�������裺
������ɫ���ʿ�����Na2O�� ������ɫ���ʿ�����Na2CO3�� ������ɫ���ʻ�������_________��
��5��Ϊȷ���ð�ɫ���ʵijɷ֣���С�����������ʵ�飺
ʵ�鲽�� | ʵ������ |
��ȡ������ɫ�������Թ��У���������ˮ������Ʒȫ������ˮ�������мӹ�����CaCl2��Һ | ���ְ�ɫ���� |
������Ƭ�̣�ȡ�ϲ���Һ���Թ��У��μ���ɫ��̪��Һ | ���������� |
��ͨ��������ʵ��ķ���������Ϊ�������������У�___����������ţ���
����ʵ��ó�������CO2��ȼ�յĻ�ѧ����ʽΪ_____��ÿ����1mol�������ת�Ƶĵ�����Ϊ____��
��6����ʵ�飨2���л����ܲ�����һ��β����������Ϊ________��������β���ķ���Ϊ_____��