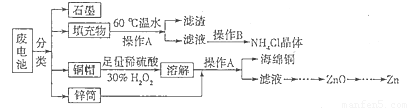
题目内容
浓硫酸与铜在加热时反应,生成二氧化硫气体的体积为2.24 L(标准状况)。试计算:
(1)被还原的硫酸的物质的量。
(2)若将生成的硫酸铜配制成500 mL溶液,则该溶液中溶质的物质的量浓度是多少?
(1)被还原的硫酸的物质的量。
(2)若将生成的硫酸铜配制成500 mL溶液,则该溶液中溶质的物质的量浓度是多少?
(l)n(H2SO4)被还原=0.1mol
(2)0.2 mol/L
(2)0.2 mol/L

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 某化学兴趣小组,通过右图装置进行硫酸与铜反应的实验探究.
某化学兴趣小组,通过右图装置进行硫酸与铜反应的实验探究.(1)提出假设:
假设一:加热时,稀H2SO4与Cu能反应.
假设二:加热时,浓H2SO4与Cu能反应.
(2)设计实验:
| 实验编号 | 实验操作 | 实验现象 |
| 1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
| 2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
(3)实验结论:通过以上实验,说明浓硫酸具有
A.强氧化性 B.脱水性 C.吸水性
(4)问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度为
 填空题
填空题