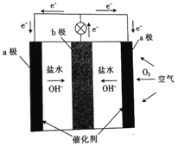
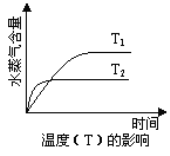��Ŀ����
����Ŀ���Ӵ��������Ṥ���У�������Ӧ��450�沢�д��������½��У�2SO2(g) + O2(g)![]() 2SO3(g) + 190 kJ
2SO3(g) + 190 kJ
(1)�÷�Ӧ��ƽ�ⳣ������ʽK =___________���÷�Ӧ450��ʱ��ƽ�ⳣ��_________500��ʱ��ƽ�ⳣ��(������������������=��)��
(2)��һ���̶��ݻ�Ϊ5L���ܱ������г���0.20 mol SO2��0.10 mol O2������Ӻ�ﵽƽ�⣬��������к�SO3 0.18 mol����v(O2) =____________mol/(L��min)
(3)��д�����SO2ת���ʵ����ַ���__________________��___________________��
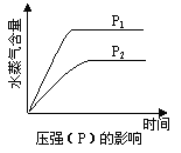
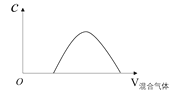
(4)���ݷ�Ӧ����ʽ������ͼ�У����Ʒ�Ӧ�����ͷ�����ں���λ�ñ������������� ___________��
(5)��SO2��SO3�Ļ���������ͨ��һ������NaOH��Һ�У�������ij���ӵ����ʵ���Ũ����ͨ��������������ͼ��ʾ��ϵ����������______________��
���𰸡�k = [SO3]2 / [O2][SO2]2 �� 0.036 mol/(L��min) ��ѹ ����  HSO3��
HSO3��
��������
��1��2SO2(g) + O2(g)![]() 2SO3(g) + 190 kJ ���÷�Ӧ��ƽ�ⳣ������ʽk = [SO3]2 / [O2][SO2]2���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ������ƽ�����淴Ӧ�����ƶ���
2SO3(g) + 190 kJ ���÷�Ӧ��ƽ�ⳣ������ʽk = [SO3]2 / [O2][SO2]2���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ������ƽ�����淴Ӧ�����ƶ���
��2����������ʽ���
��3��2SO2(g) + O2(g)![]() 2SO3(g) + 190 kJ���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ������Ӧ�����������С�ķ�Ӧ�������SO2ת���ʿ��Լ�ѹ�ͽ��¡�
2SO3(g) + 190 kJ���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ������Ӧ�����������С�ķ�Ӧ�������SO2ת���ʿ��Լ�ѹ�ͽ��¡�
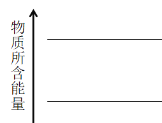
��4���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ������Ӧ�������е����������������������е���������
��5���ù��̷��������ӷ���ʽ�У�SO3+2OH-=SO42-+H2O��SO2+2OH-= SO32-+ H2O��SO2+ SO32-+ H2O=2HSO3-��HSO3-+ OH-= SO32-+ H2O��
��1��2SO2(g) + O2(g)![]() 2SO3(g) + 190 kJ ���÷�Ӧ��ƽ�ⳣ������ʽk = [SO3]2 / [O2][SO2]2���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ������ƽ�����淴Ӧ�����ƶ�����450��ʱ��ƽ�ⳣ����500��ʱ��ƽ�ⳣ���ʴ�Ϊ��k = [SO3]2 / [O2][SO2]2������
2SO3(g) + 190 kJ ���÷�Ӧ��ƽ�ⳣ������ʽk = [SO3]2 / [O2][SO2]2���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ������ƽ�����淴Ӧ�����ƶ�����450��ʱ��ƽ�ⳣ����500��ʱ��ƽ�ⳣ���ʴ�Ϊ��k = [SO3]2 / [O2][SO2]2������
��2�� 2SO2(g) + O2(g)![]() 2SO3(g)
2SO3(g)
��ʼ��mol�� 0.20 0.10 0
ת����mol�� 0.18 0.09 0.18
ƽ�⣨mol�� 0.02 0.01 0.18
v(O2) =��0.09mol/5L��/0.5min=0.036 mol/(L��min)���ʴ�Ϊ��0.036 mol/(L��min)��
��3��2SO2(g) + O2(g)![]() 2SO3(g) + 190 kJ���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ������Ӧ�����������С�ķ�Ӧ�������SO2ת���ʿ��Լ�ѹ�ͽ��£��ʴ�Ϊ����ѹ�����¡�
2SO3(g) + 190 kJ���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ������Ӧ�����������С�ķ�Ӧ�������SO2ת���ʿ��Լ�ѹ�ͽ��£��ʴ�Ϊ����ѹ�����¡�
��4���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ������Ӧ�������е����������������������е���������
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��5�� ����ͼ���֪���ù��̷��������ӷ���ʽ�У�
����ͼ���֪���ù��̷��������ӷ���ʽ�У�
SO3+2OH-=SO42-+H2O��SO2+2OH-= SO32-+ H2O��SO2+ SO32-+ H2O=2HSO3-��HSO3-+ OH-= SO32-+ H2O����������HSO3�����ʴ�Ϊ��HSO3����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�