题目内容
用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是( )
| A.NH4+为正四面体形 | B.CS2为直线形 |
| C.HCN为折线形(V形) | D.PCl3为三角锥形 |
C
解析

练习册系列答案
相关题目
一种新催化剂,能在室温下催化空气氧化甲醛:HCHO+O2 CO2+H2O,该反应
CO2+H2O,该反应
| A.反应物和生成物中都含极性分子和非极性分子 |
| B.生成1.8gH2O消耗2.24L O2 |
| C.反应时有极性键和非极性键的断裂和它们的生成 |
| D.为吸热反应 |
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
| A.SO2和SiO2 | B.CCl4和KCl | C.NaCl和HCl | D.CO2和H2O |
具有下列电子排布的原子中最难形成离子键的是( )。
| A.1s22s22p2 | B.1s22s22p5 |
| C.1s22s22p63s2 | D.1s22s22p63s1 |
下列各元素的原子在形成不同物质时,既能形成非极性键,也能形成极性键,还能形成离子键的是( )。
| A.Na | B.Fe | C.O | D.Ar |
下列有关离子键和离子化合物的说法正确的是( )
| A.凡含离子键的化合物,一定含金属元素 |
| B.在化合物MgCl2中,两个氯离子之间也存在离子键 |
| C.离子化合物一定能导电 |
| D.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
下列关于化学键的说法正确的是( )
①含有金属元素的化合物一定是离子化合物
②第IA族和第ⅦA族原子化合时,一定生成离子键
③由非金属元素形成的化合物一定不是离子化合物
④活泼金属与非金属化合时,能形成离子键
⑤离子键就是阴、阳离子间的相互引力
⑥含有离子键的化合物一定是离子化合物
⑦离子化合物中可能同时含有离子键和共价键
| A.①②⑤ | B.④⑥⑦ | C.①④③ | D.②③⑤ |
下列表示离子化合物形成过程的电子式正确的是( )
A. |
B.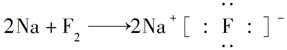 |
C.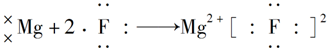 |
D.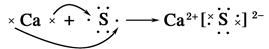 |
PH3是一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断中错误的是( )
| A.PH3分子呈三角锥形 |
| B.PH3分子是极性分子 |
| C.PH3沸点低于NH3沸点,因为P—H键键能低 |
| D.PH3分子稳定性低于NH3分子,因为N—H键键能高 |