题目内容
某化工厂排放的污水中含有Al3+、Fe3+、Hg2+、Cu2+四种离子.甲、乙、丙三位同学设计的从该污水中回收金属铜的方案分别如下:
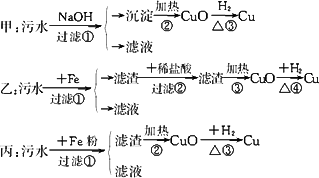
填空和回答:
(1)甲、乙、丙提出的实验方案能否制得铜?甲________,乙________,丙________.
(2)在能制得铜的方案中,会导致环境污染的一步操作是_________________.
(3)你有何改进方案?__________________
答案:
解析:
解析:
|
答案:(1)不能 能 不能 (2)乙中的第③步 (3)将②中滤渣隔绝空气加热让Hg挥发,收集,余下Cu. 解析:甲中第②步应是Al(OH)3、Fe(OH)3、Hg(OH)2、Cu(OH)2的分解,得到的应是CuO、Al2O3、Fe2O3,无HgO(分解、挥发).所以③无法实现. 丙中,①步的滤渣应是Hg、Cu、Fe,所以②步得到的是Fe2O3、CuO(Hg挥发). 乙中,②步盐酸将过量的Fe反应,②后的滤渣为Cu和Hg.乙能得到Cu,但有两方面问题,一是Hg挥发污染;二是由Cu到CuO再到Cu,浪费原料H2. |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目