题目内容
25°C时,c(CH3COOH)+ c(CH3COO-)=0.1mol/L的醋酸、醋酸钠混合溶液中,c(CH3COOH)、 c(CH3COO-)与pH的关系如图所示。下列有关该溶液的叙述不正确的是

- A.pH=4的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
- B.W点所表示的溶液中:c(Na+)+ c(H+)= c(CH3COOH)+c(OH-)
- C.将W点所表示的1.0L溶液稀释到10L,用pH计测量,溶液的pH应为5.75
- D.pH=5.5的溶液中:c(Na+)+ c(H+)- c(OH-)+c(CH3COOH)=0.1mol/L
C
试题分析:A、该溶液电离大于水解,呈酸性,正确;B、根据电荷守恒有c(Na+)+ c(H+)= c(CH3COO-)+c(OH-),该点有c(CH3COOH)=c(CH3COO-),故正确;C、W点处于醋酸的电离平衡和醋酸根的水解平衡的两个平衡体系,将此时1.0L溶液稀释到10L,稀释过程中会伴随醋酸的进一步电离和醋酸根的进一步水解,所以用pH计测量,溶液的pH不肯能为5.75,错误;D、将c(CH3COOH)+ c(CH3COO-)=0.1mol/L代入,该式为电荷守恒,正确。
考点:考查盐类水解平衡和弱酸的电离平衡相关知识,结合图像考查了三大守恒规律及相关计算。
试题分析:A、该溶液电离大于水解,呈酸性,正确;B、根据电荷守恒有c(Na+)+ c(H+)= c(CH3COO-)+c(OH-),该点有c(CH3COOH)=c(CH3COO-),故正确;C、W点处于醋酸的电离平衡和醋酸根的水解平衡的两个平衡体系,将此时1.0L溶液稀释到10L,稀释过程中会伴随醋酸的进一步电离和醋酸根的进一步水解,所以用pH计测量,溶液的pH不肯能为5.75,错误;D、将c(CH3COOH)+ c(CH3COO-)=0.1mol/L代入,该式为电荷守恒,正确。
考点:考查盐类水解平衡和弱酸的电离平衡相关知识,结合图像考查了三大守恒规律及相关计算。

练习册系列答案
相关题目

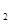 O外,还有H
O外,还有H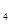 外,还有C
外,还有C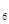 等;与之相似的氮元素的氢化物除外,还有N
等;与之相似的氮元素的氢化物除外,还有N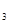 对农业、化学、国防工业具有重要意义。其合成原理为:
对农业、化学、国防工业具有重要意义。其合成原理为: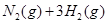

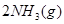
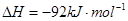
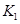 =
(只列数字表达式)
=
(只列数字表达式)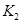 ,同
,同