题目内容
某课外活动小组同学用下图装置进行实验,试回答下列问题。

(1)若开始时开关K与a连接,则A极的电极反应式为__________________。
(2)若开始时开关K与b连接,则总反应的离子方程式为________________。有关上述实验,下列说法正确的是(填序号)__________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后(设NaCl足量)加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则有0.2 mol电子转移
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
(2)若开始时开关K与b连接,则总反应的离子方程式为________________。有关上述实验,下列说法正确的是(填序号)__________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后(设NaCl足量)加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则有0.2 mol电子转移
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为_________。此时通过阴离子交换膜的离子数_________(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口_________(填写“A”、 “D”)导出。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池负极的电极反应式为___________________。
②制得的氢氧化钾溶液从出口_________(填写“A”、 “D”)导出。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池负极的电极反应式为___________________。
(1)4OH--4e-= 2H2O + O2↑
(2)2Cl- + 2H2O 2OH- + H2↑ + Cl2↑;②④
2OH- + H2↑ + Cl2↑;②④
(3)①4OH- - 4e- = 2H2O + O2↑;小于;②D;③H2 +2OH- - 2e- = 2H2O
(2)2Cl- + 2H2O
 2OH- + H2↑ + Cl2↑;②④
2OH- + H2↑ + Cl2↑;②④(3)①4OH- - 4e- = 2H2O + O2↑;小于;②D;③H2 +2OH- - 2e- = 2H2O

练习册系列答案
相关题目
 某课外活动小组同学用如图装置进行实验,试回答下列问题.
某课外活动小组同学用如图装置进行实验,试回答下列问题. (2008?东莞模拟)某课外活动小组同学用右图装置进行实验,试回答下列问题.
(2008?东莞模拟)某课外活动小组同学用右图装置进行实验,试回答下列问题. 气、氧气、硫酸和氢氧化钾.
气、氧气、硫酸和氢氧化钾. 某课外活动小组同学用右图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.
某课外活动小组同学用右图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题. 某课外活动小组同学用如图装置进行实验,试回答下列问题:
某课外活动小组同学用如图装置进行实验,试回答下列问题: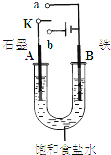 某课外活动小组同学用右图装置进行实验,试回答下列问题.
某课外活动小组同学用右图装置进行实验,试回答下列问题.