题目内容
下列图示与对应的叙述相符的是
- A.图1表示向某硫酸和硫酸铝混合溶液中加入NaOH溶液,沉淀质量与加入NaOH溶液体积的关系
- B.图2表示25℃时,用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1NaOH溶液的pH随加入盐酸体积的变化
- C.图3表示t℃时稀释冰醋酸过程中溶液导电性的变化
- D.根据图4可判断某可逆反应的正反应是吸热反应
A
分析:A、硫酸和硫酸铝的混合液中加入氢氧化钠,酸碱之间先发生中和反应,然后是铝离子和氢氧根之间的反应;
B、酸碱中和的时候pH会突变;
C、溶液的导电能力与离子浓度有关,离子浓度越大,导电性越强;
D、根据温度对化学平衡移动的影响情况来回答.
解答:A、硫酸和硫酸铝的混合液中加入氢氧化钠,酸碱之间先发生中和反应,所以开始无沉淀,然后是铝离子和氢氧根之间的反应,出现沉淀量最大和沉淀完全消失消耗氢氧根的物质的量之比是3:1,故A正确;
B、用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1NaOH溶液的pH随加入盐酸体积的变化,pH会突变,故B错误;
C、在O点时,冰醋酸中不存在自由移动的离子,所以不导电,故C错误;
D、正逆反应速率相等的状态是化学平衡状态,温度升高,正反应速率大于逆反应速率,所以平衡逆向移动,即向着吸热方向移动,所以正反应是放热反应,故D错误.
故选A.
点评:本题考查图象的有关知识,明确图中导电性与离子浓度的关系是解答本题的关键,易错选项是C,注意不能根据溶液的导电能力判断醋酸的电离程度,要根据溶液的体积判断醋酸的电离程度.
分析:A、硫酸和硫酸铝的混合液中加入氢氧化钠,酸碱之间先发生中和反应,然后是铝离子和氢氧根之间的反应;
B、酸碱中和的时候pH会突变;
C、溶液的导电能力与离子浓度有关,离子浓度越大,导电性越强;
D、根据温度对化学平衡移动的影响情况来回答.
解答:A、硫酸和硫酸铝的混合液中加入氢氧化钠,酸碱之间先发生中和反应,所以开始无沉淀,然后是铝离子和氢氧根之间的反应,出现沉淀量最大和沉淀完全消失消耗氢氧根的物质的量之比是3:1,故A正确;
B、用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1NaOH溶液的pH随加入盐酸体积的变化,pH会突变,故B错误;
C、在O点时,冰醋酸中不存在自由移动的离子,所以不导电,故C错误;
D、正逆反应速率相等的状态是化学平衡状态,温度升高,正反应速率大于逆反应速率,所以平衡逆向移动,即向着吸热方向移动,所以正反应是放热反应,故D错误.
故选A.
点评:本题考查图象的有关知识,明确图中导电性与离子浓度的关系是解答本题的关键,易错选项是C,注意不能根据溶液的导电能力判断醋酸的电离程度,要根据溶液的体积判断醋酸的电离程度.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
下列图示与对应的叙述一定正确的是( )
A、图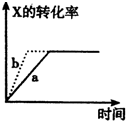 所示,反应:X(g)+2Y(g)?3Z(g),b的压强一定比a大 所示,反应:X(g)+2Y(g)?3Z(g),b的压强一定比a大 | B、图 表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂 表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂 | C、图 所示,t1℃时质量分数均为20%的甲乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等 所示,t1℃时质量分数均为20%的甲乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等 | D、图 所示,用水稀释PH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a 所示,用水稀释PH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a |


