题目内容
【题目】某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验。
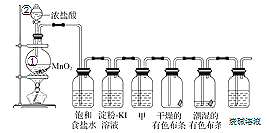
请按要求回答下列问题:
(1)仪器②的名称___________,①中反应的离子方程式__________
(2)浓盐酸的作用_______、______________,饱和食盐水的作用__________
(3)淀粉KI溶液中观察到的现象是______________,反应的离子方程式为________。
(4)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放的是________(填名称)。
(5)Cl2与烧碱溶液反应制取84消毒液的化学方程式为________。
(6)该兴趣小组用0.2mol 二氧化锰与足量的浓盐酸制备氯气,则理论上最多可制得氯气的质量是______。
【答案】分液漏斗 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 酸的作用 还原剂 除氯化氢 溶液变蓝色 Cl2+2I-=2Cl-+I2 浓硫酸 Cl2+2NaOH=NaCl+NaClO+H2O 14.2 g
Mn2++Cl2↑+2H2O 酸的作用 还原剂 除氯化氢 溶液变蓝色 Cl2+2I-=2Cl-+I2 浓硫酸 Cl2+2NaOH=NaCl+NaClO+H2O 14.2 g
【解析】
(1)根据仪器图示可知,仪器②为分液漏斗;①中发生的反应为MnO2与浓盐酸在加热条件下制备氯气的反应,其反应的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)浓盐酸在反应中有一部分被氧化,呈还原剂,有一部分生成盐,呈酸性,故浓盐酸的作用为:酸的作用、还原剂;浓盐酸为易挥发性酸,因此制备出的氯气中含有部分氯化氢气体,饱和食盐水的作用是除去氯化氢;
(3)氯气的氧化性较碘单质强,可将KI中I-氧化为I2,I2遇到淀粉会呈蓝色,因此淀粉KI溶液中现象为:溶液变蓝色;其发生的离子反应为:Cl2+2I-=2Cl-+I2;
(4)氯气在经过淀粉KI溶液时,会携带一部分水蒸气,若要实现干燥的有色布条不褪色,湿润的有色布条褪色,则通入的氯气需要为干燥氯气,故甲的作用为干燥氯气,可选用浓硫酸干燥氯气;
(5)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠、水,其反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;
(6)根据反应MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O可知,理论上0.2mol 二氧化锰完全反应生成氯气0.2mol,其质量为0.2mol×71g/mol=14.2g。
Mn2++Cl2↑+2H2O可知,理论上0.2mol 二氧化锰完全反应生成氯气0.2mol,其质量为0.2mol×71g/mol=14.2g。

 名校课堂系列答案
名校课堂系列答案【题目】下列“实验结论”与“实验操作及现象”相符的一组是
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入 | 该溶液中一定含有 |
B | 向某溶液中加入稀盐酸,有无色气体产生 | 该溶液中一定含有 |
C | 向某溶液中加入 | 该溶液中一定含有 |
D | 向某溶液中加入酚酞溶液,溶液变为红色 | 该溶液中一定含有 |
A. A B. B C. C D. D
【题目】甲醇是重要的化工原料,可用于制备丙烯、氢气等。
(1)MTO法由甲醇制备丙烯时的反应原理是:甲醇先脱水生成二甲醚,然后二甲醚与甲醇的平衡混合物脱水转化为含丙烯较多的低聚烯烃。某温度下,在密闭容器中加入CH3OH气体,发生脱水反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g),一段时间后测得各组分的浓度如表所示。
CH3OCH3(g)+H2O(g),一段时间后测得各组分的浓度如表所示。
物质 | CH3OH | CH3OCH3 | H2O |
5min浓度(mol·L-1) | 0.44 | 0.6 | 0.6 |
10min浓度mol·L-1) | 0.04 | 0.8 | 0.8 |
15min浓度(molL-1) | 0.04 | 0.8 | 0.8 |
该温度下,反应的平衡常数数值是___,CH3OH的平衡转化率是___。
(2)利用甲醇水蒸气重整制氢法是获得氢气的重要方法。反应原理如下:
反应i(主反应):CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H=+49kJmol-1
CO2(g)+3H2(g)△H=+49kJmol-1
反应ii(副反应):H2(g)+CO2(g)![]() CO(g)+H2O(g)△H=+41kJmol-1
CO(g)+H2O(g)△H=+41kJmol-1
①温度高于300℃则会同时发生CH3OH转化为CO和H2的副反应,该反应的热化学方程式是___。
②反应中,经常使用催化剂提高化学反应速率,但催化剂对反应具有选择性。一定条件下,测得CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。

从图中可知,反应的适宜温度为___,随着温度的升高,催化剂对___(填“反应i”或“反应ii”)的选择性越低。
③TiO2纳米电极电化学还原法可将副产物CO2在酸性水溶液中电解生成甲醇,生成甲醇的电极反应式是___。
【题目】常温下,某化学小组探究硝酸银溶液的性质。
装置 | 实验序号 | 实验操作 | 实验现象 |
| 实验I | 向试管中滴加2%氨水并不断振荡 | 产生棕褐色沉淀,继续滴加沉淀消失 |
实验II | 1.向试管中加入0.1mol·L-lNaOH溶液1mL 2.继续滴加3%H2O2至过量 | 1.产生棕褐色沉淀 2.产生大量无色无味气体,有黑色沉淀生成 | |
实验III | 1.向试管中滴加1mL0.1molL-1KI溶液 2.取少量上层清液于试管甲中,加入淀粉溶液 | 1.产生黄色沉淀 2.溶液无明显变化 |
已知:AgOH是一种白色固体,常温下极不稳定,易分解为棕褐色难溶于水的氧化银固体
(1)常温下,0.1mo1L-1AgNO3溶液pH约为4,请用离子方程式解释原因___。
(2)实验I中,反应的化学方程式是___。
(3)实验II中,经检验,黑色沉淀的成分为Ag。有Ag产生的化学方程式是___。经测定,实验产生的气体体积远远大于该反应的理论值,可能的原因是___。
(4)实验中,产生黄色沉淀的离子方程式是___。有同学猜想,I-有还原性,Ag+有氧化性,AgNO3溶液与KI溶液应该可以发生氧化还原反应。他设计了如图原电池,做实验IV证明了猜想成立。其中,在A烧杯中,石墨电极表面变亮,经检测这种光亮的物质为银单质。乙溶液是___,检验B烧杯中产物的操作及现象是___,该氧化还原反应的离子方程式是__。

(5)对比实验III和实验IV,实验III无I2生成的可能原因是___(写出两条)。
