题目内容
X、Y、Z、W四种元素在元素周期表中序数逐渐增大.X为非金属元素,且X、W同主族,Y、Z为同周期的相邻元素.Y的氢化物分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍.W原子的质子数等于Y、Z原子最外层电子数之和.试推断:
(1)W元素的元素符号: ;Y的单质的电子式为 ,其中的化学键属于 键(填“离子”或“共价”).
(2)用电子式表示X2Z的形成过程: .
(3)写出实验室制取Y的氢化物的化学方程式: .
(1)W元素的元素符号:
(2)用电子式表示X2Z的形成过程:
(3)写出实验室制取Y的氢化物的化学方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W四种元素在元素周期表中序数逐渐增大,Z原子最外层电子数是次外层电子数的3倍,则Z有2个电子层,最外层电子数为6,故Z为氧元素;
Y、Z 为同周期的相邻元素,Y的氢化物分子中有3个共价键,则Y为氮元素;
W原子的质子数等于Y、Z原子最外层电子数之和,则W的质子数为5+6=11,则W为钠元素;
X为非金属元素,且X、W同主族,则X为氢元素,据此解答即可.
Y、Z 为同周期的相邻元素,Y的氢化物分子中有3个共价键,则Y为氮元素;
W原子的质子数等于Y、Z原子最外层电子数之和,则W的质子数为5+6=11,则W为钠元素;
X为非金属元素,且X、W同主族,则X为氢元素,据此解答即可.
解答:
解:X、Y、Z、W四种元素在元素周期表中序数逐渐增大,Z原子最外层电子数是次外层电子数的3倍,则Z有2个电子层,最外层电子数为6,故Z为氧元素;
Y、Z 为同周期的相邻元素,Y的氢化物分子中有3个共价键,则Y为氮元素;
W原子的质子数等于Y、Z原子最外层电子数之和,则W的质子数为5+6=11,则W为钠元素;
X为非金属元素,且X、W同主族,则X为氢元素,综上所述:X为氢,Y为氮,Z为氧,W为钠,
(1)W为钠,元素符号是Na,Y为氮元素,单质为N2,分子中氮原子之间形成3对共用电子对,电子式为 ,其中的化学键属于共价键,
,其中的化学键属于共价键,
故答案为:Na; ;共价;
;共价;
(2)H2O为共价化合物,由2个氢原子和一个氧原子通过形成2个H-O键构成,形成过程用电子式表示为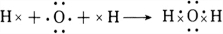 ,
,
故答案为: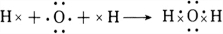 ;
;
(3)实验室利用铵盐与碱共热制备氨气,反应为2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑.
Y、Z 为同周期的相邻元素,Y的氢化物分子中有3个共价键,则Y为氮元素;
W原子的质子数等于Y、Z原子最外层电子数之和,则W的质子数为5+6=11,则W为钠元素;
X为非金属元素,且X、W同主族,则X为氢元素,综上所述:X为氢,Y为氮,Z为氧,W为钠,
(1)W为钠,元素符号是Na,Y为氮元素,单质为N2,分子中氮原子之间形成3对共用电子对,电子式为
 ,其中的化学键属于共价键,
,其中的化学键属于共价键,故答案为:Na;
 ;共价;
;共价;(2)H2O为共价化合物,由2个氢原子和一个氧原子通过形成2个H-O键构成,形成过程用电子式表示为
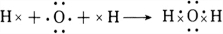 ,
,故答案为:
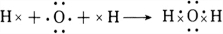 ;
;(3)实验室利用铵盐与碱共热制备氨气,反应为2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
点评:本题考查原子结构与元素推断、化学用语、化学键等,难度不大,元素Z的推断为突破口.注意基础知识的掌握.

练习册系列答案
相关题目
某学生设计了如图的方法对A盐进行鉴定:由此分析,下列结论中,正确的是( )


| A、A中一定有Fe3+ |
| B、B为AgI沉淀 |
| C、C中一定有Fe3+ |
| D、A一定为FeBr2溶液 |
人的胃液正常pH在1.2~0.3之间,酸度再高就患胃酸过多症,下列物质不宜用作治疗胃酸过多症药剂成分的是( )
| A、氧化镁粉 | B、氢氧化镁 |
| C、氧化钙 | D、纯碳酸钙粉 |
滴有酚酞试液的下列溶液,操作后颜色变深的是( )
| A、明矾溶液加热 |
| B、小苏打溶液中加入少量NaCl固体 |
| C、氨水中加入少量NH4Cl固体 |
| D、Na2CO3溶液加热 |
苯与乙烯、乙炔相比较,下列叙述中正确的是( )
| A、都易发生取代反应 |
| B、都易发生加成反应 |
| C、乙烯和乙炔易发生加成反应,苯只有在特殊条件下才发生加成反应 |
| D、乙烯和乙炔易被氧化剂氧化,苯不易被氧化 |
用酒精灯给下列仪器加热时,需要垫石棉网的有( )
①烧杯 ②坩埚 ③锥形瓶 ④蒸发皿 ⑤试管 ⑥蒸馏烧瓶.
①烧杯 ②坩埚 ③锥形瓶 ④蒸发皿 ⑤试管 ⑥蒸馏烧瓶.
| A、②④⑤ | B、①③⑥ |
| C、④⑤⑥ | D、①②③ |
 用如图的装置制取氢气,在塑料隔板上放粗锌,漏斗和带支管的试管中装有稀硫酸,若打开弹簧夹,则硫酸由漏斗流下,试管中液面上升与锌粒接触,发生反应,产生的氢气由支管导出;若关闭弹簧夹,则试管中液面下降,漏斗中液面上升,酸液与锌粒脱离接触,反应自行停止.需要时再打开弹簧夹,又可以使氢气发生.这是一种适用于室温下随制随停的气体发生装置.
用如图的装置制取氢气,在塑料隔板上放粗锌,漏斗和带支管的试管中装有稀硫酸,若打开弹簧夹,则硫酸由漏斗流下,试管中液面上升与锌粒接触,发生反应,产生的氢气由支管导出;若关闭弹簧夹,则试管中液面下降,漏斗中液面上升,酸液与锌粒脱离接触,反应自行停止.需要时再打开弹簧夹,又可以使氢气发生.这是一种适用于室温下随制随停的气体发生装置.