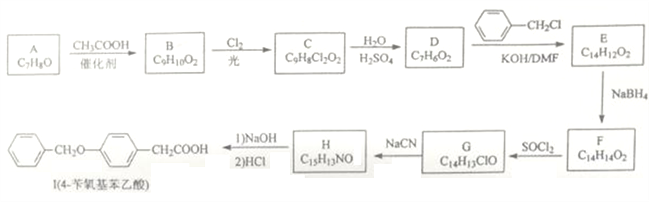
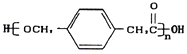
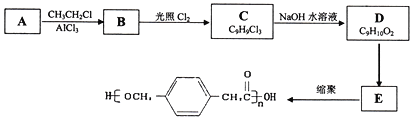
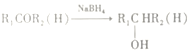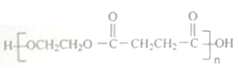题目内容
【题目】(1)相同质量的![]() 气体和
气体和![]() 气体,其分子数之比为 ______ ,氧原子数之比为 ______ ,相同条件下
气体,其分子数之比为 ______ ,氧原子数之比为 ______ ,相同条件下![]() 同温同压
同温同压![]() 的体积之比为 ______ ,密度之比为 ______ .
的体积之比为 ______ ,密度之比为 ______ .
(2)![]() 与
与![]() 的混合气体中,氧元素的质量分数为
的混合气体中,氧元素的质量分数为![]() ,则
,则![]() 与
与![]() 的物质的量之比是 ______ ,这种混合气体的密度是同温同压下氧气密度的 ______ 倍
的物质的量之比是 ______ ,这种混合气体的密度是同温同压下氧气密度的 ______ 倍![]()
【答案】5:45:65:44:53:4![]()
【解析】
:(1)设SO2与SO3均为1g,则n(SO2)=1g/64g.mol-1=1/64mol;n(SO3)=1g/80g.mol-1=1/80mol,则SO2中的n(O)=2n(SO2)=1/32mol,SO3中的n(O)=3n(SO2)=3/80mol,故分子数之比为1/64:1/80=5:4,氧原子数之比为1/32:3/80=5:6.
据阿伏加德罗定律:体积之比等于物质的量之比,即V(SO2):V(SO3)=5:4,
密度之比等于摩尔质量之比,即![]() (SO2):
(SO2):![]() (SO3) =64:80=4:5。因此,本题正确答案是: 5:4 5:6 5:4 4:5 。
(SO3) =64:80=4:5。因此,本题正确答案是: 5:4 5:6 5:4 4:5 。
(2) SO2与O2的混合气体中,氧元素的质量分数为70![]() ,则S元素的质量分数=1-70
,则S元素的质量分数=1-70![]() =30
=30![]() ,令混合气体的质量为100g,则S元素质量=100g
,令混合气体的质量为100g,则S元素质量=100g![]() 30
30![]() =30g ,故SO2的质量=30g
=30g ,故SO2的质量=30g![]() .32/64=60g则氧气为40g的质量,SO2的物质的量60g/64g.mol-1=15/16mol ,O2的物质的量=40g/32g.mol-1=5/4mol,则SO2与O2的物质的量之比为15/16mol: 5/4mol=3:4,二者平均相对分子质量=100/(15/16+ 5/4)=45.71,相同条件下,气体的摩尔质量之比等于其物质的量之比,所以混合气体的密度是同温同压下氧气密度的倍数=45.71/32=10/7,因此,本题答案是:3:4 10/7。
.32/64=60g则氧气为40g的质量,SO2的物质的量60g/64g.mol-1=15/16mol ,O2的物质的量=40g/32g.mol-1=5/4mol,则SO2与O2的物质的量之比为15/16mol: 5/4mol=3:4,二者平均相对分子质量=100/(15/16+ 5/4)=45.71,相同条件下,气体的摩尔质量之比等于其物质的量之比,所以混合气体的密度是同温同压下氧气密度的倍数=45.71/32=10/7,因此,本题答案是:3:4 10/7。