题目内容
16.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g),经5min后,测得D的浓度为0.5mo/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol•L-1•min-1.求:(1)x值;
(2)B的平均反应速率;
(3)此时A的浓度及反应开始前放入容器中的A、B的物质的量.
分析 (1)计算D的反应速率,根据化学反应速率之比等化学计量数之比进行计算得到x;
(2)化学反应速率之比等于化学方程式计量数之比;
(3)结合方程式,利用三段式进行计算,设开始前容器中A的物质的量为n,n(D)=0.5mol•L-1×2L=1mol,
3A(g)+B(g)?2C(g)+2D(g),
开始 n n 0 0
转化 1.5mol 0.5mol 1mol 1mol
5min n-1.5 n-0.5 1 1
故(n-1.5):(n-0.5)=3:5,
n=3,以此来解答.
解答 解:(1)v(D)=$\frac{0.5mol/L}{5min}$=0.1mol•L-1•min-1,v(C):v(D)=0.1mol•L-1•min-1:0.1mol•L-1•min-1=1:1=x:2,故x=2,
答:x值为2;
(2)v(C):v(B)=2:1=0.1mol•L-1•min-1:v(B),v(B)=0.05mol•L-1•min-1,
答:B的平均反应速率0.05mol•L-1•min-1;
(3)设开始前容器中A的物质的量为n,n(D)=0.5mol•L-1×2L=1mol,
3A(g)+B(g)?2C(g)+2D(g),
开始 n n 0 0
转化 1.5mol 0.5mol 1mol 1mol
5min n-1.5 n-0.5 1 1
故(n-1.5):(n-0.5)=3:5,
n=3mol,
此时A的浓度=$\frac{3mol-1.5mol}{2L}$=0.75 mol/L,
答:此时A的浓度为0.75 mol/L,反应开始前放入容器中的A、B的物质的量3mol.
点评 本题考查了化学反应速率、化学平衡的计算应用,主要是化学方程式中计量数之比等于化学反应速率之比的应用,掌握基础是解题关键,题目较简单.

| A. | 在标准状况下,22.4L H2O的分子数为NA | |
| B. | 48g O3气体含有NA个O3分子 | |
| C. | 0.5mol•L-1 AlCl3溶液中含有0.5NA个Al3+ | |
| D. | 1molMg变为Mg2+时失去的电子数目为NA |
| A. | 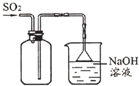 收集SO2 收集SO2 | |
| B. | 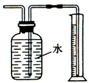 测量Cu与浓硝酸反应生成二氧化氮体积 测量Cu与浓硝酸反应生成二氧化氮体积 | |
| C. | 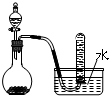 二氧化锰固体和双氧水制取O2 二氧化锰固体和双氧水制取O2 | |
| D. | 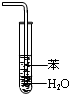 吸收HCl 吸收HCl |
| A. | 0.05mol•L-1 | B. | 0.25mol•L-1 | C. | 0.1mol•L-1 | D. | 0.5mol•L-1 |
| A. | (2m-1.6)克 | B. | 2(m-1.6)克 | C. | (m-1.6)克 | D. | 3.2克 |