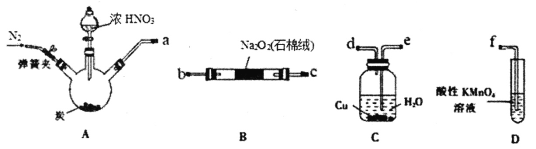
��Ŀ����
����Ŀ�����������ڹ�ũҵ��ҽѧ������й㷺��Ӧ�á������ǹ�ҵ���Ʊ��������ص����ַ������ش��������⣺
��ֱ�ӷ�

��1������XΪ___���ѧʽ����
��2����ת�������跢����Ӧ�����ӷ�Ӧ����ʽ___����֪��Ca3(PO4)2������ˮ����
��3����Һ���м���״���������___��
��4������������___��
������кͷ�
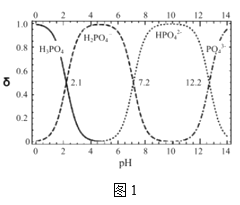
��5������������Һ��ߴ��������ڷ�Ӧ���з����кͷ�Ӧ�Ʊ��������ء�д���˷�Ӧ�����ӷ�Ӧ����ʽ___����ͼ1�ж��Ʊ��������أ���80%�������pH��Χ___��
��ⷨ
��ⷨ��ȡKH2PO4��ԭ����ͼ2��ʾ��һ�����£����ɵõ�NaClO3��
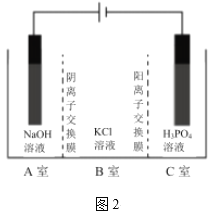
��6����___�ң����ţ��ɵõ�KH2PO4��д������ClO3�����ĵ缫��Ӧʽ___��
���𰸡�HCl Ca3(PO4)2+4H++3SO42��![]() 2H2PO4��+3CaSO4 �ٽ��������ص����� ���� OH��+H3PO4=H2PO4��+H2O 3��6.5 C Cl��+6OH����6e��=ClO3��+3H2O
2H2PO4��+3CaSO4 �ٽ��������ص����� ���� OH��+H3PO4=H2PO4��+H2O 3��6.5 C Cl��+6OH����6e��=ClO3��+3H2O
��������
Ũ������Ȼ���180��C������Ӧ�����Ȼ��������������أ���ˮϡ�͵õ�������ص���Һ�������������70��Cת��Ϊ�������ƺ�����ƣ����˺����Һ����״��ٽ��������ص���������Һ��������غͼ״�������õ��״�������أ�
��(1)�����̿�֪��KCl��Ũ����õ�KHSO4������Ԫ���غ������
(2)Ũ������Ȼ��ؼ��ȷ�Ӧ�������Ȼ������壬�ٽ���Ӧ������У�
(3)�����̿�֪KHSO4��Һ����Ca3(PO4)270�����ת���õ�KH2PO4����һ����ΪCaSO4���ݴ���д��
(4)��Һ���м���״��õ���Ʒ�������أ��ʼ״��������Ǵٽ��������ص�������
(5)�������������ӷ����ѻӷ������ʣ��ݴ˷�����
��(6)����������Һ��ߴ��������ڷ�Ӧ���з����кͷ�Ӧ�Ʊ��������أ�ͼ�������֪��������(��80%)��pH��Χ��
��(7)C�����ӵ�Դ�����õ������������������Ӽ�����ͨ�������ӽ���Ĥ����C�ң��õ���Ʒ�������أ�������ͨ�������ӽ���Ĥ��A��ʧȥ���ӷ���������Ӧ���ݴ˷�����
��(1)�����̿�֪��KCl��Ũ����õ�KHSO4����õ�������ΪHCl��
(2)����ȡ�����裬Ũ��������KCl�ܷ�����ѧ��Ӧ��ԭ���ǣ���HCl��������ƽ��������Ӧ������У�
(3)�����̿�֪KHSO4��Һ����Ca3(PO4)270�����ת���õ�KH2PO4����һ����ΪCaSO4�����ӷ���ʽΪ��Ca3(PO4)2+4H++3SO42��![]() 2H2PO4��+3CaSO4��
2H2PO4��+3CaSO4��
(4)��Һ���м���״��õ���Ʒ�������أ��ʼ״��������Ǵٽ��������ص�������
(5)����������õ��ӷ��ļ״��͵������Һ����������ɵã�
��(6)����������Һ��ߴ��������ڷ�Ӧ���з����кͷ�Ӧ�Ʊ��������أ���Ӧ�����ӷ�Ӧ����ʽ��OH��+H3PO4��H2PO4��+H2O��ͼ�������֪�ж��Ʊ���������(��80%)�����pH��Χ��3��6.5��
��(7)C�����ӵ�Դ�����õ������������������Ӽ�����ͨ�������ӽ���Ĥ����C�ң��õ���Ʒ�������أ�������ͨ�������ӽ���Ĥ��A��ʧȥ���ӷ���������Ӧ�õ�ClO3�����缫��ӦʽΪ��Cl��+6OH����6e����ClO3��+3H2O��