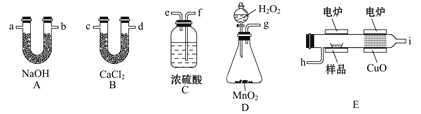
��Ŀ����
����Ŀ��ij��Ԫ����B(OH)2(K1=5.9��10-2��K2=6.4��10-5)����10mLϡB(OH)2��Һ�еμӵ�Ũ�����ᣬB(OH)2��B(OH)+��B2+��Ũ�ȷ���![]() ����ҺpOH[pOH=-lgc(OH-)]�仯�Ĺ�ϵ��ͼ������˵����ȷ����
����ҺpOH[pOH=-lgc(OH-)]�仯�Ĺ�ϵ��ͼ������˵����ȷ����

A.����a����Ӧ�����������Һ�����Ϊ5mL
B.�������������Һ�����Ϊ10mLʱ����c(Cl-)��c(B(OH)+)��c(H+)��c(OH-)��c(B2+)
C.����b��c(OH-)=6.4��l0-5
D.�������������Һ�����Ϊ15mLʱ���ڣ�c(Cl-)+c(OH-)��c(H+)��c(OH-)��c(B2+)+ c(B(OH)+)+c(H+)
���𰸡�C
��������
A.���������������Ϊ5mL����B(OH)2+HCl��B(OH)Cl+H2O��֪��ʱ��Һ��������B(OH)2��B(OH)+������ˮ��͵���������ͬ��������Һ�в����ܺ�������B(OH)2��B(OH)+��A����
B���������������Һ�����Ϊ10mLʱ����Ӧ����B(OH)Cl����Һ�Լ��ԣ���c(OH-)��c(H+)��B����
C.����b��B(OH)+��B2+�ķֲ�������ȣ�����ƽ��Ũ����ȣ���K2= =6.4��10-5����֪b��c(OH-)=6.4��10-5��C��ȷ��
=6.4��10-5����֪b��c(OH-)=6.4��10-5��C��ȷ��
D.�������������Һ�����Ϊ15mLʱ�����ɵ����ʵ�����B(OH)Cl��BCl2�Ļ����Һ����Һ��ѭ����غ㣬�����c(Cl-)+c(OH-)=c(H+)+2c(B2+)+ c[B(OH)+)]��D����
�ʺ���ѡ����C��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�