题目内容
2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示.已知1 mol SO2(g)氧化为1 mol SO3的ΔH=-99 kJ·mol-1.请回答下列问题:
2SO3(g)反应过程的能量变化如图所示.已知1 mol SO2(g)氧化为1 mol SO3的ΔH=-99 kJ·mol-1.请回答下列问题:
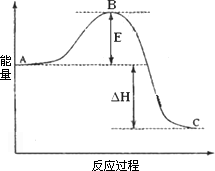
(1)图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?________.该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是________;
(2)图中ΔH=________KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化.写出该催化循环机理的化学方程式________;
(4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH________(要求计算过程).
答案:
解析:
解析:
(1)反应物能量(1分) 生成物能量(1分) 无(1分) 降低(1分) 因为催化剂改变了反应的历程使活化能E降低(1分)
(2)-198(1分)
(3)SO2+V2O5=SO3+2VO2 4VO2+O2=2V2O5(2分)
(4)S(s)+O2(g)=2SO2(g);ΔH1=-296KJ·mol-1,SO2(g)+1/2O2(g)![]() SO3(g);ΔH2=-99KJ·mol-1,3S(s)+9/2O2(g)=3SO3(g);ΔH=3(ΔH1+ΔH2)=-1185 KJ·mol-1.(2分)
SO3(g);ΔH2=-99KJ·mol-1,3S(s)+9/2O2(g)=3SO3(g);ΔH=3(ΔH1+ΔH2)=-1185 KJ·mol-1.(2分)

练习册系列答案
相关题目
对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是
2SO3(g),能增大正反应速率的措施是
| A.通入大量O2 | B.增大容器容积 | C.移去部分SO3 | D.降低体系温度 |
 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
 2SO3(g)
△H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
2SO3(g)
△H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是