题目内容
| A.该反应的反应热△H<0 |
| B.反应物的总能量低于生成物的总能量 |
| C.该反应是吸热反应 |
| D.加入催化剂后反应放出的热会减少 |

B、依据图象可知反应物的总能量高于生成物的总能量,故B错误;
C、反应是放热反应,故C错误;
D、催化剂改变反应速率,不改变平衡,反应的焓变不变,故D错误;
故选A.

 名校课堂系列答案
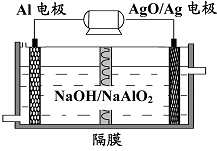
名校课堂系列答案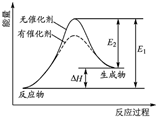 某反应的反应过程中能量变化如图所示.下列叙述正确的是( )
某反应的反应过程中能量变化如图所示.下列叙述正确的是( )| A、该反应为吸热反应,△H=E2-E1 | B、图中E2表示正反应的活化能 | C、催化剂不能改变反应的方向和焓变 | D、该反应一定不能自发进行 |
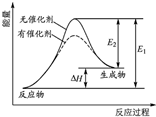 某反应的反应过程中能量变化如图所示.下列叙述正确的是( )
某反应的反应过程中能量变化如图所示.下列叙述正确的是( )| A、该反应一定不能自发进行 | B、图中E2表示正反应的活化能 | C、该反应为吸热反应,△H=E2-E1 | D、催化剂不能改变反应的方向和焓变 |
(10分)(1) 氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H-H键能为436KJ·mol-1,N≡N键能为945 KJ·mol-1,N-H键能为391 KJ·mol-1。写出合成氨反应的热化学方程式:
(2)可逆反应N2 +3H2 2NH3 在恒容密闭容器中进行,达到平衡状态的标志是
2NH3 在恒容密闭容器中进行,达到平衡状态的标志是
①单位时问内生成n mo1 N2的同时生成3n mol H2
②单位时间内1个N≡N键断裂的同时,有6个N—H键断裂[来源:Z.xx.k.Com]
③容器中N2、H2、NH3的物质的量为1:3:2
④常温下,混合气体的密度不再改变的状态
⑤常温下,混合气体的平均相对分子质量不再改变的状态
(3)恒温下,往一个2L的密闭容器中充入2.6 mol H2和1 mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所:
|
时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
C(NH3)/mol·L-1 |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5min内,消耗N2的平均反应速率为 ;此条件下该反应的化学平衡常数K= ;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,化学平衡将向 (填“正反应”或“逆反应”)方向移动。
(4)氨是氮肥工业的重要原料。某化肥厂以天然石膏矿(主要成分CaSO4)为原料生产铵态氮肥(NH4)2SO4,(已知Ksp(CaSO4)=7.10×10-5 Ksp(CaCO3)=4.96×10-9)其工艺流程如下:

请写出制备(NH4)2SO4的反应方程式: ;
并利用有关数据简述上述反应能发生的原因