题目内容
20.在同温同压下,下列各组热化学方程式中Q2>Q1的是( )| A. | H2(g)+Cl2(g)=2HCl(g)△H=-Q1; $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H=-Q2 | |
| B. | C(s)+$\frac{1}{2}$O2(g)=CO (g)△H=-Q1;C(s)+O2(g)=CO2(g)△H=-Q2 | |
| C. | 2H2(g)+O2(g)=2H2O(l)△H=-Q1;2H2(g)+O2(g)=2H2O(g)△H=-Q2 | |
| D. | S(g)+O2(g)=SO2(g)△H=-Q1;S(s)+O2(g)=SO2(g)△H=-Q2 |
分析 选项中的反应都为放热反应,由热化学方程式可知Q越大,放出的热量越多,物质反应的越彻底,参加反应的物质的量越多,放出的热量越多,物质的聚集状态不同,Q不同,以此解答该题.
解答 解:A.参加反应的物质的量越多,放出的热量越多,则Q2<Q1,故A错误;
B.因CO(气)→CO2(气)为放热过程,后者反应比较彻底,放出的热量更多,则Q2>Q1,故B正确;
C.H2O(气)→H2O(液)为放热过程,则Q2<Q1,故C错误;
D.S(固)→S(气)为吸热过程,则Q2<Q1,故D错误;
故选B.
点评 本题考查反应热的大小比较,题目难度中等,本题注意比较反应热的角度,化学反应中,反应的程度、物质的量以及物质的聚集状态不同,反应放出或吸收的热量是不同的.

练习册系列答案
相关题目
10.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,11.2L CO2所含的原子数为1.5NA | |
| B. | 常温常压下,48g O2含有的氧原子数为3NA | |
| C. | 标准状况下,22.4L H2中所含原子数为NA | |
| D. | 标准状况下,22.4L 四氯化碳的分子数为NA |
11.如图用石墨电极电解CuCl2溶液.下列分析正确的是( )


| A. | a极为电源正极 | B. | 每生成6.4gCu,转移电子0.2 mol | ||
| C. | 阳极反应式:Cu2++2e→Cu | D. | 在直流电源中电流从b流向a |
8.制造玻璃的主要原料为纯碱、石灰石和( )
| A. | 金刚砂 | B. | 石英 | C. | 水玻璃 | D. | 粘土 |
15.某温度下反应N2O4(g)?2NO2(g)(△H>0)在密闭容器中达到平衡,下列说法不正确的是( )
| A. | 加压时(体积变小),将使正反应速率增大 | |
| B. | 保持体积不变,加入少许NO2,将使正反应速率减小 | |
| C. | 保持体积不变,加入少许N2O4,再达到平衡时,颜色变深 | |
| D. | 保持体积不变,通入He,再达平衡时颜色不变 |
5.已知气体的密度与它的摩尔质量成正比.一只气球若放在空气(空气的平均摩尔质量是29g•mol-1)中可静止不动,那么在相同条件下该气球放在下列气体中会下沉的是( )
| A. | O2 | B. | Cl2 | C. | CO2 | D. | CH4 |
9.下列反应既属于氧化还原反应,又属于置换反应的是( )
| A. | 2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3 | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | CaO+CO2═CaCO3 | D. | 2H2O+2Na═2NaOH+H2↑ |
10.将25.6克的铜完全溶于适量的浓硝酸中,收集到氮的氧化物(NO2、N2O4、NO)的混合气,这些混合气恰好能被250ml 2mol/L NaOH溶液完全吸收,生成NaNO2和NaNO3的盐溶液,则其中NaNO3的物质的量为( )
| A. | 0.1 mol | B. | 0.2 mol | C. | 0.3mol | D. | 0.4 mol |
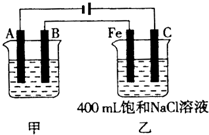 如图为相互串联的甲、乙两电解池.试回答:
如图为相互串联的甲、乙两电解池.试回答: