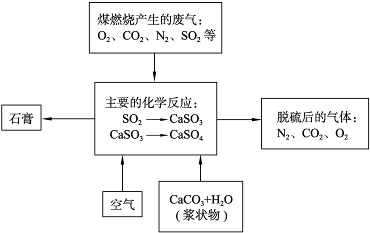
题目内容
[化学--化学与技术]
污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来.如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2H2Dz?Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中.

(1)写出双硫腙和Fe3+络合的离子方程式:______.萃取Fe3+的过程中要控制适宜的酸度,如果溶液的pH过大,其后果是______.
(2)如图是用双硫腙(H2Dz)~CCl4络合萃取某些金属离子的酸度曲线,它反映了萃取某些金属离子时适宜的pH范围.E%表示某种金属离子以络合物形式萃取分离的百分率.
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙 络合萃取法处理废水.
络合萃取法处理废水.
①欲完全将废水中的Hg2+分离出来,须控制溶液的pH=______.
②当调节pH=2时,铋(Bi)的存在形式有______.
(3)污水中的亚汞离子( )必须转换成汞离子(Hg2+)才能用双硫腙络合.某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化
)必须转换成汞离子(Hg2+)才能用双硫腙络合.某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化 ,写出该反应的化学方程式:______.
,写出该反应的化学方程式:______.
解:(1)双硫腙和Fe3+络合生成Fe(HDz)3和氢离子,该离子反应为Fe3++3H2Dz?Fe(HDz)3+3H+,萃取Fe3+的过程中要控制适宜的酸度,如果溶液的pH过大,Fe3+、OH-结合生成Fe(OH)3沉淀,故答案为:Fe3++3H2Dz?Fe(HDz)3+3H+;Fe(OH)3;
(2)①由图可知,pH=1时只有Hg2+沉淀,可完全将废水中的Hg2+分离出来,故答案为:1;
②由图可知,pH=2时,铋(Bi)的存在形式有Bi3+和Bi(HDz)3,故答案为:Bi3+和Bi(HDz)3;
(3)Hg2Cl2与二硫酸钾(K2S2O8)反应生成硫酸汞和KCl,该反应为Hg2Cl2+K2S2O8═2HgSO4+2KCl,故答案为:Hg2Cl2+K2S2O8═2HgSO4+2KCl.
分析:(1)双硫腙和Fe3+络合生成Fe(HDz)3和氢离子,萃取Fe3+的过程中要控制适宜的酸度,如果溶液的pH过大,离子之间结合生成沉淀;
(2)①由图可知,pH=1时只有Hg2+沉淀;
②pH=2时,铋(Bi)的存在形式有金属阳离子和络离子;
(3)Hg2Cl2与二硫酸钾(K2S2O8)反应生成硫酸汞和KCl.
点评:本题以污水处理考查离子反应,注重信息的抽取和利用及离子反应方程式的书写的考查,(2)中②为解答的易错点,易忽略络离子,题目难度较大.
(2)①由图可知,pH=1时只有Hg2+沉淀,可完全将废水中的Hg2+分离出来,故答案为:1;
②由图可知,pH=2时,铋(Bi)的存在形式有Bi3+和Bi(HDz)3,故答案为:Bi3+和Bi(HDz)3;
(3)Hg2Cl2与二硫酸钾(K2S2O8)反应生成硫酸汞和KCl,该反应为Hg2Cl2+K2S2O8═2HgSO4+2KCl,故答案为:Hg2Cl2+K2S2O8═2HgSO4+2KCl.
分析:(1)双硫腙和Fe3+络合生成Fe(HDz)3和氢离子,萃取Fe3+的过程中要控制适宜的酸度,如果溶液的pH过大,离子之间结合生成沉淀;
(2)①由图可知,pH=1时只有Hg2+沉淀;
②pH=2时,铋(Bi)的存在形式有金属阳离子和络离子;
(3)Hg2Cl2与二硫酸钾(K2S2O8)反应生成硫酸汞和KCl.
点评:本题以污水处理考查离子反应,注重信息的抽取和利用及离子反应方程式的书写的考查,(2)中②为解答的易错点,易忽略络离子,题目难度较大.

练习册系列答案
相关题目
【化学-化学与技术】某强酸性工业废水中含有Fe2+、Fe3+、Cu2+,设计实验方案用沉淀法除去铁离子,得到较纯的Cu2+溶液.有关氢氧化物沉淀的pH如下表:
(1)从表中数据分析,为什么不能直接加NaOH将溶液pH调到9.7来除去Fe3+和Fe2+ .
(2)实际应用中则是先加一定量的次氯酸钠,然后再调节溶液pH.次氯酸钠的作用是 .
(3)pH应调节到什么范围 ,为什么 .
(4)调节pH适宜的试剂是
A.氢氧化钡B.碳酸镁,C、氧化铜、D、稀盐酸
理由 .
| 金属离子 | pH | |
| 开始沉淀 | 沉淀完全 | |
| Fe2+ | 6.3 | 9.7 |
| Cu2+ | 4.7 | 6.7 |
| Fe3+ | 1.9 | 3.2 |
(2)实际应用中则是先加一定量的次氯酸钠,然后再调节溶液pH.次氯酸钠的作用是
(3)pH应调节到什么范围
(4)调节pH适宜的试剂是
A.氢氧化钡B.碳酸镁,C、氧化铜、D、稀盐酸
理由
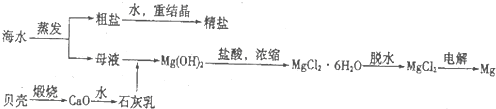
【化学--化学与技术】
海洋是一座巨大的宝藏,海洋资源的开发与利用具有广阔的前景.某地海水的pH在7.5~8.6之间,其中主要离子的含量如下表:
(1)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1.其中阴 (阳)离子交换膜只允许阴(阳)离子通过.
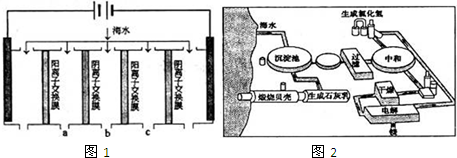
①阴极的电极反应式为 .
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式 .
③淡水的出口为a、b、c中的 出口.
(2)如图2是工业上生产镁的流程.
①干燥步骤中将氯化镁的水合晶体转化为无水氯化镁的操作方法是 .
②整个生产流程中,循环使用的物质是 .
③有人认为:过滤步骤后,直接加热Mg(OH)2得MgO,再电解熔融的MgO制金属镁,这样可优化生产过程.你的观点是 (填“同意”或“不同意”);理由是 .
海洋是一座巨大的宝藏,海洋资源的开发与利用具有广阔的前景.某地海水的pH在7.5~8.6之间,其中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO 42- | HCO 3+ | 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

①阴极的电极反应式为
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
③淡水的出口为a、b、c中的
(2)如图2是工业上生产镁的流程.
①干燥步骤中将氯化镁的水合晶体转化为无水氯化镁的操作方法是
②整个生产流程中,循环使用的物质是
③有人认为:过滤步骤后,直接加热Mg(OH)2得MgO,再电解熔融的MgO制金属镁,这样可优化生产过程.你的观点是