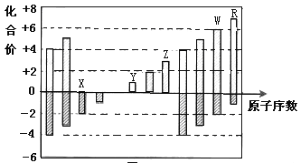
题目内容
【题目】把与下列元素有关性质相符的曲线标号填入相应空格中:
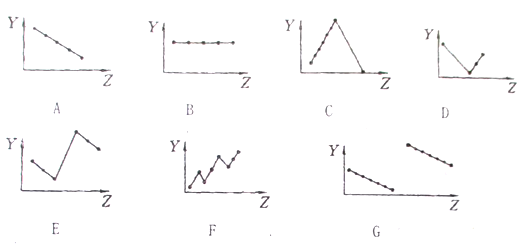
(1)第IIA族元素的价电子数_________;
(2)第三周期元素的最高化合价有_______ ;
(3)碱金属单质熔点_______ ;
(4)第三周期离子Na+、Mg2+、A13+、P3-、S2-、Cl-的离子半径_______ ;
(5)第二、三周期元素随原子序数递增原子半径的变化_______。
【答案】 B C A E G
【解析】(1)同一主族元素价电子数相等,与原子序数无关,第IIA族元素价电子数都是2,图像选B,正确答案:B。
(2)第三周期元素的最高正化合价随着原子序数增大而增大,稀有气体除外,所以化合价从+1升高到+7,稀有气体为0价,图像C符合;正确答案:C。
(3)IA族金属元素单质的熔点与其原子半径成反比,所以碱金属族单质的熔点随着原子序数增大而减小,图像A符合;正确答案:A。
(4)电子层数越多,离子半径越大,电子层结构相同的离子其离子半径随着原子序数增大而减小,则Na+、Mg2+、Al3+的离子半径依次减小,P3-、S2-、Cl-的离子半径依次减小,阴离子半径大于阳离子半径,图像E符合,正确答案:E。
(5)第二、三周期元素,电子层数越大其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,故G符合,正确答案:G。

练习册系列答案
相关题目